题目内容
14.下列事实得出的结论正确的是( )| 事实 | 结论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:P>N |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na2AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HClO与H2SO3发生氧化还原反应;
B.N2比白磷稳定得多,与N≡N有关;
C.金属钠可从熔融的KCl中置换出K,K为气态,从平衡体系中逸出,平衡正向移动;
D.Al为活泼金属,混合物中铝离子得到电子.
解答 解:A.HClO与H2SO3发生氧化还原反应,不能比较Sl、S的非金属性,故A错误;
B.N2比白磷稳定得多,与N≡N有关,而非金属性N>P,故B错误;
C.金属钠可从熔融的KCl中置换出K,K为气态,从平衡体系中逸出,平衡正向移动,反应才能发生,而金属性K>Na,故C错误;
D.Al为活泼金属,电解法冶炼金属时,混合物中铝离子得到电子,钠离子没有得到电子,可知金属性Na>Al,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握发生的反应、非金属性和金属性比较方法为解答的关键,侧重分析与评价能力的考查,注意比较非金属性的角度,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
4.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
5.下列说法中,不正确的是( )
| A | B | C | D |
 |  |  | 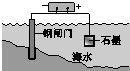 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
2.下列叙述中,不能说明X元素比Y元素的非金属性强的是( )
| A. | 与H2化合时,X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | X原子的原子序数比Y原子的原子序数大 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
9.已知4NH3+5O2?4NO+6H2O(g),若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系是( )
| A. | 5υ(O2)=4υ(NH3) | B. | 6υ(H2O)=5υ(O2) | C. | 3υ(H2O)=2υ(NH3) | D. | 5υ(NO)=4υ(O2) |
2.根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
9.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使CH3COOH的电离程度增大,可以采取的措施是( )
①加少量CH3COONa固体 ②升高温度 ③加少量冰醋酸 ④加水.
①加少量CH3COONa固体 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
6.一定温度下,可逆反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )
| A. | 单位时间内生成 n mol A2,同时生成 n mol AB | |
| B. | 体系内的总压不随时间变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | 单位时间内生成 n mol A2的同时,生成n mol B2 |
7.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与盐酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |