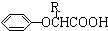题目内容
化工厂铬渣中含有Na2SO4及少量Cr2O72-、Fe3+,图1是从铬渣提取Na2SO4和利用副产品制取FeCl3的工艺流程.已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol?L-1)时pH分别为3.6和5.

(1)①操作C加硫酸酸化而不选用盐酸的原因是 .
②酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为 .
③根据图2溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号).
A.蒸发浓缩,冷却结晶,过滤
B.蒸发浓缩,趁热过滤
④温度相同时Ksp[Cr(OH)3] Ksp[Fe(OH)3](填“>”或“<”)
(2)已知FeCl3从溶液中析出的是FeCl3?6H2O,在空气中直接加热FeCl3?6H2O晶体得不到纯的无水FeCl3,原因是 (用化学方程式表示).由FeCl3?6H2O晶体得到纯的无水FeCl3的合理方法是 .
(3)图3所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是 .
A.a-b-c-d-e-e-f-g-h
B.a-c-b-d-e-h-i-f
C.a-d-e-c-b-h-i-g
D.a-e-d-c-b-h-i-g
若以KMnO4和浓盐酸为原料来制取Cl2,并希望能控制反应速率,图4最适合的装置是 (已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O).

(1)①操作C加硫酸酸化而不选用盐酸的原因是
②酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为
③根据图2溶解度(S)∽温度(T)曲线,操作B的最佳方法为
A.蒸发浓缩,冷却结晶,过滤
B.蒸发浓缩,趁热过滤
④温度相同时Ksp[Cr(OH)3]
(2)已知FeCl3从溶液中析出的是FeCl3?6H2O,在空气中直接加热FeCl3?6H2O晶体得不到纯的无水FeCl3,原因是
(3)图3所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
A.a-b-c-d-e-e-f-g-h
B.a-c-b-d-e-h-i-f
C.a-d-e-c-b-h-i-g
D.a-e-d-c-b-h-i-g
若以KMnO4和浓盐酸为原料来制取Cl2,并希望能控制反应速率,图4最适合的装置是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)①酸性条件下Cr2O72-能把Cl-氧化为氯气;
②酸性条件下,Cr2O72-可被SO32-还原成Cr3+,SO32-被氧化为SO42-;
③趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出;
④Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol?L-1)时pH分别为3.6和5,分别计算二者的Ksp,然后比较;
(2)氯化铁中铁离子水解生成氢氧化铁,得不到纯净的氯化铁;应在氯化氢气流中加热失去结晶水;
(3)实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,在此过程中应注意氯气制取后的除杂和干燥,以及与铁粉反应后氯气尾气的处理等问题即可解答;KMnO4和浓盐酸为原料来制取Cl2,不需要加热,为了便于控制反应,应该选用分液漏斗加盐酸,为了使液体容易滴下应该用导管连通分液漏斗和烧瓶.
②酸性条件下,Cr2O72-可被SO32-还原成Cr3+,SO32-被氧化为SO42-;
③趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出;
④Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol?L-1)时pH分别为3.6和5,分别计算二者的Ksp,然后比较;
(2)氯化铁中铁离子水解生成氢氧化铁,得不到纯净的氯化铁;应在氯化氢气流中加热失去结晶水;
(3)实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,在此过程中应注意氯气制取后的除杂和干燥,以及与铁粉反应后氯气尾气的处理等问题即可解答;KMnO4和浓盐酸为原料来制取Cl2,不需要加热,为了便于控制反应,应该选用分液漏斗加盐酸,为了使液体容易滴下应该用导管连通分液漏斗和烧瓶.
解答:
解:(1)①酸性条件下Cr2O72-能把Cl-氧化为氯气,氯气有毒会污染空气,同时生成NaCl引入杂质使得到的硫酸钠不纯;
故答案为:酸性环境Cl-被Cr2O72-氧化生成Cl2污染环境,引入NaCl杂质导致产品不纯;
②酸性条件下,Cr2O72-可被SO32-还原成Cr3+,SO32-被氧化为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
③根据如图2溶解度(S)~温度(T)曲线,操作B的最佳方法为 先将混合溶液蒸发浓缩,趁热过滤,趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出,
故答案为:B;
④Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol?L-1)时pH分别为3.6和5,则Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32,
Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-5×(10-10.4)3=1.0×10-36.2,则Ksp[Cr(OH)3]>Ksp[Fe(OH)3];
故答案为:>;
(2)在空气中直接加热FeCl3?6H2O晶体得不到纯的无水FeCl3,原因是在空气中直接加热FeCl3?6H2O晶体会发生水解生成氢氧化铁和HCl,即FeCl3?6H2O
Fe(OH)3+3HCl↑+3H2O,为了抑制其水解应该在干燥的HCl气流中加热脱水;
故答案为:FeCl3?6H2O
Fe(OH)3+3HCl↑+3H2O;在干燥的HCl气流中加热脱水;
(3)实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,故首先要制备氯气,故最先使用的仪器是a;
制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是g→f;
故仪器连接顺序正确的是a-e-d-c-b-h-i-g,故D正确;
KMnO4和浓盐酸为原料来制取Cl2,不需要加热,为了便于控制反应,应该选用分液漏斗滴加盐酸,为了使液体容易滴下应该用导管连通分液漏斗和烧瓶,使分液漏斗与烧瓶中压强相同,所以只有④符合.
故答案为:D;④.
故答案为:酸性环境Cl-被Cr2O72-氧化生成Cl2污染环境,引入NaCl杂质导致产品不纯;
②酸性条件下,Cr2O72-可被SO32-还原成Cr3+,SO32-被氧化为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
③根据如图2溶解度(S)~温度(T)曲线,操作B的最佳方法为 先将混合溶液蒸发浓缩,趁热过滤,趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7?2H2O结晶析出,
故答案为:B;
④Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol?L-1)时pH分别为3.6和5,则Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32,
Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-5×(10-10.4)3=1.0×10-36.2,则Ksp[Cr(OH)3]>Ksp[Fe(OH)3];
故答案为:>;
(2)在空气中直接加热FeCl3?6H2O晶体得不到纯的无水FeCl3,原因是在空气中直接加热FeCl3?6H2O晶体会发生水解生成氢氧化铁和HCl,即FeCl3?6H2O
| ||
故答案为:FeCl3?6H2O
| ||
(3)实验室制备少量无水FeCl3需要用纯净、干燥的氯气在加热条件下与铁粉反应,故首先要制备氯气,故最先使用的仪器是a;
制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是g→f;
故仪器连接顺序正确的是a-e-d-c-b-h-i-g,故D正确;
KMnO4和浓盐酸为原料来制取Cl2,不需要加热,为了便于控制反应,应该选用分液漏斗滴加盐酸,为了使液体容易滴下应该用导管连通分液漏斗和烧瓶,使分液漏斗与烧瓶中压强相同,所以只有④符合.
故答案为:D;④.
点评:本题综合考查了离子方程式的书写、氧化还原反应、沉淀溶解平衡和Ksp的有关计算、水解原理的应用、实验方案设计等内容,侧重于有关原理和基础知识的综合应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
起固定氮作用的化学反应是( )
| A、N2与H2在一定条件下反应生成NH3 |
| B、NO遇O2转化为NO2 |
| C、硝酸工厂用NH3氧化法制NO |
| D、由NH3合成尿素 |
配制0.1mol/L盐酸溶液480mL,用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数)( )mL注入烧杯中.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
| A、3.5 | B、3.8 |
| C、2.5 | D、4.2 |
某种烃与H2以物质的量比为1:1加成后的产物是: ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )
 ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )| A、1种 | B、2种 | C、3种 | D、4种 |
与氨碱法相比较,联合制碱法最突出的优点是( )
| A、设备少 |
| B、原料易得 |
| C、循环利用的物质多 |
| D、NaCl利用率高 |
 有等质量的A、B两金属的粉末,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如图.下列说法不正确的是( )
有等质量的A、B两金属的粉末,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如图.下列说法不正确的是( )| A、金属活动性强弱:A>B |
| B、反应后A、B可能都有剩余 |
| C、消耗B的质量一定小于A的质量 |
| D、消耗的稀硫酸和稀盐酸质量一定不相等 |
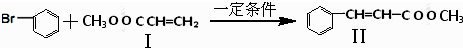

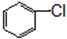 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为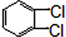 为原料合成
为原料合成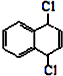 的路线.
的路线.
 是有机物A的同分异构体,下列说法错误的是
是有机物A的同分异构体,下列说法错误的是