题目内容
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:
A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )

| A、反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是 0.225 mol?L-1?s-1 |
| B、该温度下,压缩气体体积至1L,反应的平衡常数增大 |
| C、恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 |
| D、在上述反应体系中加入催化剂,化学反应速率增大,则E1和E2均减小 |
考点:产物的百分含量随浓度、时间的变化曲线
专题:
分析:A、根据反应方程式的化学计算量数关系可知,VA=VC,以此进行计算;
B、反应的平衡常数只与温度有关,温度不变,反应的平衡常数不变;
C、缩小反应容器的体积,压强增大,反应速率增大;
D、加入催化剂降低反应的活化能,加快反应速率.
B、反应的平衡常数只与温度有关,温度不变,反应的平衡常数不变;
C、缩小反应容器的体积,压强增大,反应速率增大;
D、加入催化剂降低反应的活化能,加快反应速率.
解答:
解:A、根据反应方程式的化学计算量数关系可知,VA=VC=
=0.1125mol?L-1?s-1,故A错误;
B、反应的平衡常数只与温度有关,温度不变,反应的平衡常数不变,故B错误;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故D正确.
故选AB.
| ||
| 4S |
B、反应的平衡常数只与温度有关,温度不变,反应的平衡常数不变,故B错误;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故D正确.
故选AB.
点评:本题考查化学平衡移动图象题,题目难度不大,注意本题反应方程式的特征,为解答该题的关键.

练习册系列答案
相关题目
在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是( )
①FeCl3与Cu反应
②FeCl3与H2S反应
③FeCl3与KI反应
④FeCl3滴入沸水中
⑤FeCl3与NaHCO3反应
⑥FeCl3溶液中滴入石蕊试液.
①FeCl3与Cu反应
②FeCl3与H2S反应
③FeCl3与KI反应
④FeCl3滴入沸水中
⑤FeCl3与NaHCO3反应
⑥FeCl3溶液中滴入石蕊试液.
| A、③④⑤⑥ | B、③④⑤ |
| C、④⑤⑥ | D、①②③ |
下图所示为海水综合利用部分流程,有关说法错误的是:( )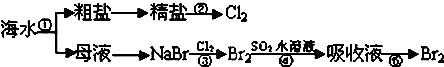
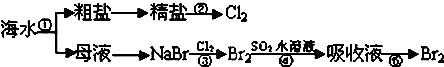
| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 |
| B、②是一个将电能转化为化学能的过程 |
| C、③④⑤涉及的反应均为氧化还原反应 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
下列各图所示装置属于原电池的是( )
A、 NaCl溶液 |
B、 HCl溶液 |
C、 CuSO4溶液 |
D、 蔗糖溶液 |
下列表示对应化学反应的离子方程式正确的是( )
| A、NH4HSO4溶液中加入足量的Ba(OH)2溶液:OH-+H++Ba2++SO4-2=BaSO4↓+H2O |
| B、小苏打溶液中加入足量的Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ |

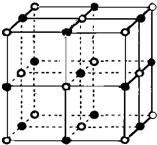 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.