题目内容
8.已知8gCH4完全燃烧生成CO2和液态水时,放出445kJ热量.现有CH4和CO混合气体共2mol,完全燃烧后生成CO2和36g液态水,并放出1170kJ量.求:(1)写出甲烷燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ•mol-1
(2)混合气体中CH4的质量分数为多少?
分析 (1)根据n=$\frac{m}{M}$计算出8.0g甲烷的物质的量,然后可计算出1mol甲烷完全燃烧生成液态水放出的热量,最后利用热化学方程式的书写原则写出甲烷燃烧的热化学方程式.
(2)根据氢原子守恒,即n(H)=4n(CH4)=2n(H2O),即n(CH4)=$\frac{1}{2}$n(H2O),求CH4的物质的量,并求其质量分数.
解答 解:(1)8.0g CH4的物质的量为:$\frac{8.0g}{16g/mol}$=0.5mol,0.5molCH4完全燃烧生成液态水放出445kJ热量,则1mol CH4完全燃烧生成液态水放出的热量为:445kJ×$\frac{1mol}{0.5mol}$=890kJ,
则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ•mol-1;
(2)n(H2O)=$\frac{36g}{18g/mol}$=2mol,根据氢原子守恒,即即n(H)=4n(CH4)=2n(H2O),即n(CH4)=$\frac{1}{2}$n(H2O)=1mol,故w(CH4)=$\frac{1mol×16g/mol}{1mol×16g/mol+(2mol-1mol)×28g/mol}$=36.4%.
答:合气体中CH4的质量分数为为36.4%.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.NA为阿伏伽德罗常数的值,下列叙述错误的是( )
| A. | 18 g H2O中含的质子数为10 NA | |
| B. | 12 g金刚石含有的电子数为4 NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
3.烯烃A与氢气加成后的生成物是2,2-二甲基丁烷,则A的名称是( )
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-1-丁烯 | ||
| C. | 3,3-二甲基-1-丁烯 | D. | 3,3-二甲基-2-丁烯 |
13.某研究小组通过实验探究Al、Fe、Cu及其化合物的性质,操作正确且能达到实验目的是( )
| A. | 将铝、铜、铁片插入浓硫酸,以证明常温下Al、Fe、Cu能否与浓硫酸反应 | |
| B. | 加过量NaOH溶液,过滤弃去沉淀,以除去混在Al2O3中的Fe2O3 | |
| C. | 将铁器、铜器放入盐酸中浸泡,以除去表面的铁锈和铜绿[Cu2(OH)2CO3] | |
| D. | 将FeCl3、CuCl2溶液在蒸发皿中加热蒸干,以制得FeCl3、CuCl2固体 |
20.常温下,有下列四种溶液:①0.1 mol/L NaOH溶液 ②pH=11 NaOH溶液 ③0.1 mol/L CH3COOH溶液 ④pH=3 CH3COOH溶液 ⑤pH=3 HCl溶液,下列说法正确的是( )
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将等体积的④、⑤分别加蒸馏水稀释至pH=6,加入水的体积:④>⑤ | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,得到的溶液pH>7 |
17.下列有机物的命名不正确的是( )
| A. | 2,3,3一三甲基戊烷 | B. | 2-甲基-2-丁烯 | ||
| C. | 3,3一二甲基-4-乙基戊烷 | D. | 3,3,4一三甲基已烷 |
18.下列图示与对应的叙述相符的是( )
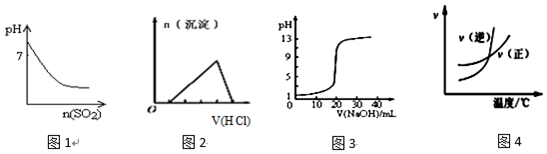

| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |