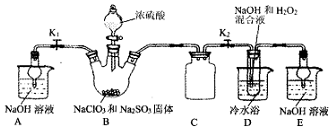
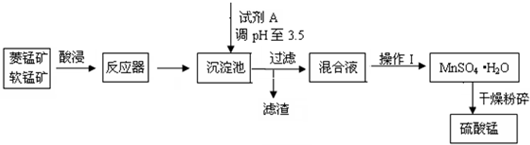
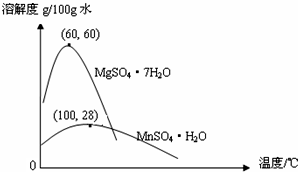
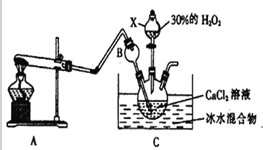
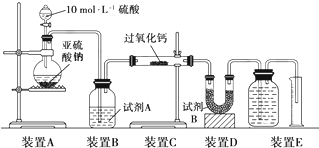
题目内容
12.铁及其化合物可广泛用于电池行业.I.某碱性电池的总反应为NiO2+Fe+2H2O=Fe(OH)2+Ni(OH)2.
(1)该电池放电时,发生还原反应的物质是A(填字母),负极反应式为Fe-2e-+2OH-=Fe(OH)2.
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)若放电时生成Fe(OH)2的质量18g,则外电路中转移的电子数是0.4mol.
Ⅱ.在碱性环境下,Mg-Na2FeO4可以形成高效的原电池,该电池的总反应为3Mg+2Na2FeO4+8H2O=2Fe(OH)3+3Mg(OH)2+4NaOH.
(3)(3)该电池中Na+流向正(填“正”或“负”,下同)极,Fe(OH)3在正极生成.
分析 I.根据碱性电池的总反应为NiO2+Fe+2H2O=Fe(OH)2+Ni(OH)2,可判断该电池负极发生反应的物质为Fe失电子发生氧化反应,反应式为:Fe-2e-+2OH-=Fe(OH)2,正极为NiO2得电子发生还原反应,反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,据此分析计算;
Ⅱ.原电池阳离子移向正极,Na2FeO4在正极得电子发生还原反应生成Fe(OH)3.
解答 解:I.(1)由碱性电池的总反应为NiO2+Fe+2H2O=Fe(OH)2+Ni(OH)2,可知正极为NiO2得电子发生还原反应,负极为Fe失电子发生氧化反应,反应式为:Fe-2e-+2OH-=Fe(OH)2,故答案为:A;Fe-2e-+2OH-=Fe(OH)2;
(2)由负极为Fe失电子发生氧化反应,反应式为:Fe-2e-+2OH-=Fe(OH)2,则若放电时生成Fe(OH)2的质量18g,则外电路中转移的电子数是$\frac{18g}{90g/mol}$×2=0.4mol,故答案为:0.4mol;
Ⅱ.(3)原电池阳离子移向正极,所以Na+流向正极,Na2FeO4在正极得电子发生还原反应生成Fe(OH)3,所以Fe(OH)3在正极生成,故答案为:正;正.
点评 本题考查原电池原理,题目难度中等,注意根据化合价变化分析电极方程式的书写,为解答该题的关键,也是易错点,做题时注意体会.

练习册系列答案
相关题目
2.某烃的结构简式为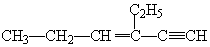 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、6 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、4、6 |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W的最高正价和最低负价的代数和为0,下列说法正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
7.分子式为C9H12属于芳香烃的有机物共有(不含立体异构)( )
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 9种 |
7.下列有关化学用语表示正确的是( )
| A. | 硫化钠的电子式: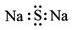 | B. | 中子数为10的氧原子:${\;}_8^{10}O$ | ||
| C. | 硫离子的结构示意图: | D. | HC1O的结构式:H-O-Cl |