题目内容
绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染.最理想的“原子经济”就是原子利用率为100%.下列制取有机物的反应中原子利用率最低的是( )
A、nCH2=CH2
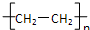 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、 |
考点:绿色化学,有机化学反应的综合应用
专题:有机反应
分析:根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;即生成物质只有一种.
解答:
解:A.产物只有一种,即原子的利用率为100%;
B.产物只有一种,即原子的利用率为100%;
C.反应物的原子总数为24,产物乙醇的原子总数为18,即原子的利用率为
×100%=75%;
D.反应物的原子总数为14,产物溴苯的原子总数为12,即原子的利用率为
×100%=85.7%;
故原子利用率最低的是C选项,
故选C.
B.产物只有一种,即原子的利用率为100%;
C.反应物的原子总数为24,产物乙醇的原子总数为18,即原子的利用率为
| 18 |
| 24 |
D.反应物的原子总数为14,产物溴苯的原子总数为12,即原子的利用率为
| 12 |
| 14 |
故原子利用率最低的是C选项,
故选C.
点评:本题考查绿色化学,难度不大.要抓住绿色化学的特征:原子利用率为100%.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列关于化学与生产、生活的认识错误的是( )
| A、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
| B、在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| C、积极推广太阳能、风能、地热能及核能等的使用,减少化石燃料的使用 |
| D、雾霾天气与燃煤、机动车、工业、扬尘等污染源排放量大有关 |
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:CH2OH(CHOH)4CHO |
B、聚丙烯的结构简式: |
C、Cl-的结构示意图: |
D、甲烷的球棍模型: |
在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A.
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A.
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、①③⑥ |
下列离子方程式的书写不正确的是( )
| A、实验室用过氧化氢从海带中提碘:2I-+H2O2+2H+═I2+2H2O |
| B、用二氧化硫的溶液吸收溴蒸气:Br2+SO2+2H2O═4 H++2 Br-+SO42- |
| C、用氯气氧化氢溴酸:Cl2+2 Br-=Br2+2 Cl - |
| D、用醋酸中和氢氧化钠溶液:H++OH-═H2O |
 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子. .将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )
.将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )