题目内容
 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.(1)C原子的电子排布式为
(2)当n=2时,B的原子结构示意图为
(3)若D元素与Fe形成某种晶体,该晶体的晶胞如图所示.则晶体的化学式是
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有1个电子,则D元素原子电子排布式为1s22s22p6 3s23p1,故D为Al元素,
(1)氧原子核外电子数为8,根据核外电子排布规律书写;
若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4;碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键;
(3)晶胞中含有4个Al原子,根据均摊法计算晶胞中Fe原子数目,据此确定该晶体的化学式;
计算晶胞的质量与体积,根据ρ=
计算晶胞的密度.
(1)氧原子核外电子数为8,根据核外电子排布规律书写;
若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4;碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键;
(3)晶胞中含有4个Al原子,根据均摊法计算晶胞中Fe原子数目,据此确定该晶体的化学式;
计算晶胞的质量与体积,根据ρ=
| m |
| V |
解答:
解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有3个电子,则D元素原子电子排布式为1s22s22p6 3s23p3,故D为P元素,
(1)氧原子核外电子数为8,核外电子排布为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键,属于σ键,
故答案为:1s22s22p4;σ;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4,原子结构示意图为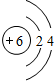 ,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键,其化学式为SiO2,
故答案为: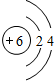 ;分子;共价键;SiO2;
;分子;共价键;SiO2;
(3)晶胞中含有4个Al原子,晶胞中Fe原子数目=1+8×
+6×
+12×
=8,Fe与Al原子数目之比为2:1,故该晶体的化学式为Fe2Al;
晶胞的质量=4×
g,晶胞的边长为a nm,则晶胞体积=(a×10-7 cm)3=a3×10-21 cm3,故晶胞的密度=
=
g/cm3,
故答案为:Fe2Al;
.
(1)氧原子核外电子数为8,核外电子排布为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为s1电子与2p电子成键,属于σ键,
故答案为:1s22s22p4;σ;
(2)当n=2时,B为碳元素,原子有2个电子层,各层电子数为2、4,原子结构示意图为
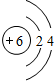 ,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,碳原子与氧原子之间形成共价键,其化学式为SiO2,
故答案为:
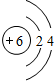 ;分子;共价键;SiO2;
;分子;共价键;SiO2;(3)晶胞中含有4个Al原子,晶胞中Fe原子数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
晶胞的质量=4×
| 139 |
| NA |
4×
| ||
| a3×10-21 cm3 |
| 5.56×1023 |
| a3NA |
故答案为:Fe2Al;
| 5.56×1023 |
| a3NA |
点评:本题是对物质结构与性质的考查,涉及结构性质位置关系、核外电子排布、晶体类型、化学键、晶胞计算等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
分子式C9H12的芳香烃,其可能的结构有( )
| A、3种 | B、5种 | C、8种 | D、7种 |
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两连接,可组成若干原电池.若 a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则下列说法正确的是( )
| A、b的活动性一定在氢之后 |
| B、若a与b相连,则a为原电池的正极 |
| C、若c与b相连,则b极上发生氧化反应 |
| D、若将稀H2SO4换为NaOH溶液,a、c分别为镁、铝,则a极上有气泡产生 |
绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染.最理想的“原子经济”就是原子利用率为100%.下列制取有机物的反应中原子利用率最低的是( )
A、nCH2=CH2
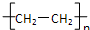 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、 |
下列各组中离子在水溶液中能大量共存的是( )
| A、Na+、CO32-、Cl-、AlO2- |
| B、H+、Fe3+、NO3-、S2- |
| C、Al3+、K+、S2-、SO42- |
| D、NH4+、NO3-、SiO32-、CO32- |
 在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.
在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.