题目内容
下列离子方程式的书写不正确的是( )
| A、实验室用过氧化氢从海带中提碘:2I-+H2O2+2H+═I2+2H2O |
| B、用二氧化硫的溶液吸收溴蒸气:Br2+SO2+2H2O═4 H++2 Br-+SO42- |
| C、用氯气氧化氢溴酸:Cl2+2 Br-=Br2+2 Cl - |
| D、用醋酸中和氢氧化钠溶液:H++OH-═H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.酸性条件下,过氧化氢和碘离子发生氧化还原反应;
B.二氧化硫具有还原性,溴具有氧化性,二者发生发生氧化还原反应生成硫酸和氢溴酸;
C.氯气和氢溴酸发生置换反应;
D.醋酸为弱电解质,写化学式.
B.二氧化硫具有还原性,溴具有氧化性,二者发生发生氧化还原反应生成硫酸和氢溴酸;
C.氯气和氢溴酸发生置换反应;
D.醋酸为弱电解质,写化学式.
解答:
解:A.酸性条件下,过氧化氢和碘离子发生氧化还原反应,离子反应方程式为:2I-+H2O2+2H+═I2+2H2O,故A正确;
B.二氧化硫具有还原性,溴具有氧化性,二者发生发生氧化还原反应生成硫酸和氢溴酸,离子反应方程式为Br2+SO2+2H2O═4 H++2 Br-+SO42-,故B正确;
C.氯气和氢溴酸发生置换反应,离子反应方程式为Cl2+2 Br-=Br2+2 Cl -,故C正确;
D.醋酸为弱电解质,写化学式,离子反应方程式为:CH3COOH+OH-═H2O+CH3COO-,故D错误;
故选D.
B.二氧化硫具有还原性,溴具有氧化性,二者发生发生氧化还原反应生成硫酸和氢溴酸,离子反应方程式为Br2+SO2+2H2O═4 H++2 Br-+SO42-,故B正确;
C.氯气和氢溴酸发生置换反应,离子反应方程式为Cl2+2 Br-=Br2+2 Cl -,故C正确;
D.醋酸为弱电解质,写化学式,离子反应方程式为:CH3COOH+OH-═H2O+CH3COO-,故D错误;
故选D.
点评:本题考查了离子反应方程式的判断,根据反应实质结合原子守恒、电荷守恒、转移电子守恒来分析解答,明确离子反应方程式的书写规则是解本题关键,单质、气体、沉淀、弱电解质都要写化学式.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染.最理想的“原子经济”就是原子利用率为100%.下列制取有机物的反应中原子利用率最低的是( )
A、nCH2=CH2
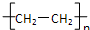 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、 |
含Ba(OH)21mol稀溶液与足量稀盐酸反应,放出114.6KJ热,表示该反应中和热的化学方程式正确的是( )
| A、Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=-114.6KJ/mol | ||||
| B、Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=+114.6KJ/mol | ||||
C、
| ||||
D、
|
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ |
| C、等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+H2O |
| D、Al(NO3)3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
 如图所示不同温度和压强下在一定容积的密闭容器中,对可逆反应4L(g)?2M(g)+N(g)△H>0,平衡状态时(P1>P2)图中y轴是指( )
如图所示不同温度和压强下在一定容积的密闭容器中,对可逆反应4L(g)?2M(g)+N(g)△H>0,平衡状态时(P1>P2)图中y轴是指( )| A、L的体积分数 |
| B、混合气体的总物质的量 |
| C、混合气体的平均分子量 |
| D、气体混合物的密度 |
下列各组中离子在水溶液中能大量共存的是( )
| A、Na+、CO32-、Cl-、AlO2- |
| B、H+、Fe3+、NO3-、S2- |
| C、Al3+、K+、S2-、SO42- |
| D、NH4+、NO3-、SiO32-、CO32- |
聚丙烯酸酯的结构为 ,下列有关它的说法中,不正确的是( )
,下列有关它的说法中,不正确的是( )
 ,下列有关它的说法中,不正确的是( )
,下列有关它的说法中,不正确的是( )| A、它可由CH2=CH-COOR经加成聚合反应得到 |
| B、聚丙烯酸酯材料是一种混合物 |
| C、在一定条件下能发生水解反应 |
| D、在一定条件下能发生加成反应 |

