题目内容
6.按下面的实验过程填空: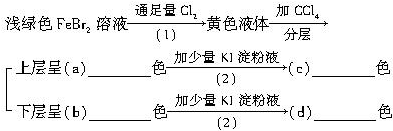
写出上述反应的化学方程式:
(1)2FeBr2+3Cl2═2FeCl3+2Br2;
(2)2FeCl3+2KI═2FeCl2+2KCl+I2;
(3)2KI+Br2═I2+2KBr.
分析 FeBr2与足量Cl2反应得到FeCl3与Br2,加入CCl4,萃取溶液中的溴,有机层在下层,呈橙红色,氯化铁溶液在上层,上层液中加入KI淀粉溶液,铁离子氧化碘离子生成碘单质,碘遇淀粉显蓝色,下层液中加入KI淀粉溶液,溴氧化碘离子得到碘单质,溶解在四氯化碳中呈紫色,由此分析解答.
解答 解:(1)反应(1)是FeBr2与足量Cl2反应得到FeCl3与Br2,反应化学方程式为:2FeBr2+3Cl2═2FeCl3+2Br2,
故答案为:2FeBr2+3Cl2═2FeCl3+2Br2;
(2)反应(2)是铁离子氧化碘离子生成碘单质,反应化学方程式为:2FeCl3+2KI═2FeCl2+2KCl+I2,
故答案为:2FeCl3+2KI═2FeCl2+2KCl+I2;
(3)反应(3)是溴单质氧化碘离子生成碘单质,反应化学方程式为:2KI+Br2═I2+2KBr,故答案为:2KI+Br2═I2+2KBr.
点评 本题以框图题形式,考查元素化合物性质、萃取等,熟练掌握元素化合物性质是关键,侧重基础知识的巩固,难度不大.

练习册系列答案
相关题目
16.化学在生产和生活中有着广泛的应用.下列说法中错误的是( )
| A. | 煤的气化和液化过程都有化学变化 | |
| B. | 防腐剂福尔马林(含甲醛)可用作食品保鲜剂 | |
| C. | 用碘酒滴加在阿斯匹林、去痛片等药片上,可检验药片是否含有淀粉 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的目的 |
17.为了除去CuCl2酸性溶液中的Fe3+,可在加热条件下加入一种试剂,该试剂是( )
| A. | 氢氧化钠 | B. | 硫酸 | C. | 氧化铜 | D. | 氨水 |
14.下列有关碳酸钠和碳酸氢钠的说法不正确的是( )
| A. | 在水中的溶解度:碳酸钠>碳酸氢钠 | |
| B. | 热稳定性:碳酸钠>碳酸氢钠 | |
| C. | 等物质的量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,两者产生二氧化碳一样多 | |
| D. | 足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多 |
1.氢气是化工行业重要原料之一.
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解250mL饱和食盐水一段时间后,溶液质量减轻0.365g(假设气体全部逸出).生成的氢气在标准状况下的体积为112mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷经此过程生成0.27m3氢气,则甲烷的裂解率为18%(体积均在相同条件下测定).
(3)已知:CxHy+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
计算原混合气体中甲烷与乙烷的物质的量之比.
(4)合成氨生产过程中,消耗氮氢混合气2000m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解250mL饱和食盐水一段时间后,溶液质量减轻0.365g(假设气体全部逸出).生成的氢气在标准状况下的体积为112mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷经此过程生成0.27m3氢气,则甲烷的裂解率为18%(体积均在相同条件下测定).
(3)已知:CxHy+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
(4)合成氨生产过程中,消耗氮氢混合气2000m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
11.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| B. | 用25mL量筒量取12.36mL盐酸 | |
| C. | 用托盘天平称量8.7g食盐 | |
| D. | 将40 g NaOH溶解于1 L 水中配得1 mol•L-1的溶液 |
18.已知:键能是指破坏(或生成)1mol化学键所需要吸收(或放出)的能量.几种化学键的键能如表:
则反应2CH4(g)C2H2(g)+3H2(g)的△H为(C2H2的结构式为H-C≡C-H)( )
| 化学键 | H-H | C-H | C≡C |
| 键能/kJ•mol-1 | a | b | c |
| A. | (b-c-a)kJ•mol-1 | B. | (c+3a-4b)kJ•mol-1 | C. | (6b-c-3a)kJ•mol-1 | D. | (c+3a-6b)kJ•mol-1 |
15.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 化合物:干冰,冰水混合物,烧碱 | B. | 同素异形体:活性炭,C60,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:漂白粉,纯净矿泉水,盐酸 |
16.下列离子方程式正确的是( )
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 足量二氧化碳通入NaOH溶液:CO2+OH-═HCO3- | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |