题目内容
下列有关实验的做法不正确的是( )
| A、从海带提取单质碘时最后用苯进行了萃取,苯层应由分液漏斗的上口倒出 |
| B、分别给碳酸钠和碳酸氢钠两种固体加热,再用澄清石灰水可以区分这两种固体 |
| C、配制0.1000mol?L-1氢氧化钠溶液时,定容时俯视刻度线,所配溶液浓度会偏大 |
| D、次氯酸钠溶液可用于漂白和环境的消毒杀菌,通入SO2漂白及杀菌作用将增强 |
考点:化学实验方案的评价,分液和萃取,配制一定物质的量浓度的溶液,探究碳酸钠与碳酸氢钠的性质
专题:实验评价题
分析:A.萃取剂为苯,密度比水小;
B.碳酸氢钠受热分解,而碳酸钠不分解;
C.定容时俯视刻度线,溶液体积偏小;
D.NaClO和SO2发生氧化还原反应生成硫酸钠、NaCl.
B.碳酸氢钠受热分解,而碳酸钠不分解;
C.定容时俯视刻度线,溶液体积偏小;
D.NaClO和SO2发生氧化还原反应生成硫酸钠、NaCl.
解答:
解:A.从海带提取单质碘时最后用苯进行了萃取,萃取剂为苯,密度比水小,分层后苯层在上层,则苯层应由分液漏斗的上口倒出,故A正确;
B.碳酸氢钠受热分解,而碳酸钠不分解,则再用澄清石灰水可以区分这两种固体,变浑浊的可判断碳酸氢钠,故B正确;
C.定容时俯视刻度线,溶液体积偏小,由c=
可知,所配溶液浓度会偏大,故C正确;
D.NaClO和SO2发生氧化还原反应生成硫酸钠、NaCl,则通入SO2漂白及杀菌作用将减弱,也可能消失,故D错误;
故选D.
B.碳酸氢钠受热分解,而碳酸钠不分解,则再用澄清石灰水可以区分这两种固体,变浑浊的可判断碳酸氢钠,故B正确;
C.定容时俯视刻度线,溶液体积偏小,由c=
| n |
| V |
D.NaClO和SO2发生氧化还原反应生成硫酸钠、NaCl,则通入SO2漂白及杀菌作用将减弱,也可能消失,故D错误;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及萃取、物质鉴别、溶液配制、氧化还原反应及漂白性等,把握物质的性质及反应原理为解答的关键,注重高频考点的考查,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
下列说法中正确的是( )
| A、放热反应在常温下都能发生 |
| B、放热反应一定比吸热反应的反应速率快 |
| C、若某可逆反应的正反应放热,则逆反应一定是吸热 |
| D、吸热反应在任何条件下都不能自发进行 |
电化学降解法治理水中硝酸盐的污染原理如图所示.下列说法正确的是( )


| A、B为电源正极 |
| B、电解过程中H+向阳极移动 |
| C、阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH- |
| D、理论上电解过程中阴、阳两极产生的气体在同温同压下体积比为2:5 |
下列说法正确的是( )
| A、工业合成氨反应使用催化剂,加快化学反应速率,并提高产率,增大经济效益 |
| B、水的离子积常数Kw只与温度有关,但加酸、碱、盐一定会影响水的电离程度 |
| C、等物质的量浓度,等体积的NaCl溶液和NaClO溶液中离子数目前者大于后者 |
| D、将等PH的盐酸溶液和醋酸溶液稀释相同的倍数,稀释后PH:盐酸<醋酸 |
下列离子方程式中正确的是( )
| A、澄清石灰水与稀盐酸反应Ca(OH) 2+2H+=Ca2++2H2O |
| B、氢氧化钡与硫酸铜溶液混合:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu (OH) 2↓ |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、氯化铁溶液与氨水反应Fe3++3OH-=Fe (OH)3↓ |
下列物质的水溶液中存在溶质分子的是( )
| A、HCl |
| B、NaOH |
| C、Na2CO3 |
| D、酒精 |
制备氰氨化钙的化学方程式为CaCO3+2HCN═CaCN2+CO↑+H2↑+CO2↑,在反应中( )
①氢元素被氧化,碳元素被还原
②HCN既是氧化剂又是还原剂
③CaCN2是氧化产物,H2是还原产物
④CO为氧化产物,H2为还原产物.
①氢元素被氧化,碳元素被还原
②HCN既是氧化剂又是还原剂
③CaCN2是氧化产物,H2是还原产物
④CO为氧化产物,H2为还原产物.
| A、①② | B、③④ | C、①④ | D、②③ |
下列说法不正确的是( )
| A、C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同 |
| B、在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6 |
C、某基态原子的核外电子排布图为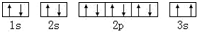 ,它违背了泡利不相容原理 ,它违背了泡利不相容原理 |
| D、用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 |
下列说法正确的是( )
| A、CS2为V形的极性分子 |
| B、电子云示意图中的每个小黑点都表示一个电子 |
| C、非极性键也可以存在于化合物中 |
| D、甲烷、氨和水都是由极性键结合而成的极性分子 |