题目内容
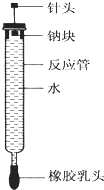 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.(1)钠与水反应的离子方程式为
(2)实验中“钠块熔化为闪亮的小球”说明
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为
考点:钠的化学性质
专题:金属概论与碱元素
分析:(1)钠与水反应生成氢氧化钠和氢气;
(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性;
(3)根据实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,利用化学方程式2Na+2H2O=2NaOH+H2↑;
(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性;
(3)根据实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,利用化学方程式2Na+2H2O=2NaOH+H2↑;
解答:
解:(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性,滴加酚酞溶液变红;
故答案为:钠的熔点低,反应放热;酚酞溶液;
(3)实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,其物质的量为
=
mol,
由2Na+2H2O=2NaOH+H2↑
2 1
n(Na)
mol
n(Na)=
mol×2=
mol,质量为m(Na)=
mol×23g/mol=
g;
故答案为:
;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性,滴加酚酞溶液变红;
故答案为:钠的熔点低,反应放热;酚酞溶液;
(3)实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,其物质的量为
| a mL |
| V mL/mol |
| a |
| V |
由2Na+2H2O=2NaOH+H2↑
2 1
n(Na)
| a |
| V |
n(Na)=
| a |
| V |
| 2a |
| V |
| 2a |
| V |
| 46a |
| V |
故答案为:
| 46a |
| V |
点评:本题考查钠的性质与化学计算,题目难度不大,注意相关基础知识的积累是关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
在加入铝能够产生H2的某无色透明的溶液,下列各组离子肯定能大量共存的是( )
| A、K+、MnO4-、SO42-、Cl- |
| B、Na+、K+、SO42-、Cl- |
| C、Na+、K+、I-、NO3- |
| D、Ca2+、HCO3-、NO3-、SO42- |
下列反应中,属于同一反应类型的是( )
| A、由甲苯氧化制苯甲酸;苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
| B、丙烯与溴水反应;乙炔一定条件下与氯化氢反应生成氯乙烯 |
| C、乙炔一定条件下反应生成苯;溴乙烷和NaOH醇溶液共热 |
| D、乙醇与浓硫酸共热至170℃生成乙烯; 乙醇与浓硫酸共热至140℃生成乙醚 |
国际化学组织已将周期表中原主、副族的族号去掉而改称列,如碱金属为第1列,稀有气体为第18列.按此规定,下列叙述正确的是( )
| A、第1列元素均能形成M2O和M2O2型化合物 |
| B、第14列元素所形成的化合物种类最多 |
| C、第17列元素均有最高价氧化物R2O7 |
| D、最外层有两个电子的原子都在第2列 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: (1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是
(1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是