题目内容
14.常温下三氯化氮(NCl3)是一种淡黄色液体.以下关于NCl3的说法中,正确的是( )| A. | 分子中 N-Cl键是非极性键 | B. | 分子中不存在孤对电子 | ||
| C. | 三氯化氮分子结构呈三角锥形 | D. | 因N-Cl 键键能大,它的沸点高 |
分析 A.相同非金属原子之间形成的共价键为非极性共价键,不同原子之间形成的为极性共价键;
B.NCl3中N原子成3个N-Cl键,有1对孤对电子;
C.根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4,故N原子采取SP3杂化,分子形状为三角锥形;
D.无氢键的分子晶体的相对分子质量决定其沸点,与其化学键无关.
解答 解:A.不同原子之间形成的为极性共价键,NCl3分子中存在N-Cl极性共价键,故A错误;
B.NCl3中N原子成3个N-Cl键,孤电子对个数=$\frac{5-3×1}{2}$=1,故B错误;
C.NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,分子形状为三角锥形,故C正确;
D.NCl3晶体为分子晶体,无氢键,分子晶体的相对分子质量决定其沸点,NCl3在常温下是一种淡黄色液体,NCl3沸点低,与相对分子质量有关,与N-Cl键能大无关,故D错误;
故选C.
点评 本题以信息的形式考查NCl3分子空间结构、极性共价键等知识,明确信息并结合所学知识即可解答,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
4.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的己烷所含的分子数为0.5NA | |
| B. | 28g乙烯在氧气中完全燃烧消耗氧气分子的数目为3NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为10NA | |
| D. | 分子式为C2H6O中含有C-H(碳氢键)的数目为6NA |
5.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60的结构.下列叙述正确的是( )
| A. | 该物质有很高的熔点、很大的硬度 | |
| B. | 该物质形成的晶体属分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | C60易溶于水 |
2.下列物质属于芳香烃,但不是苯的同系物的是( )
① CH3 ②
CH3 ② CH=CH2 ③
CH=CH2 ③ NO2
NO2
④ OH ⑤
OH ⑤ ⑥
⑥
①
 CH3 ②
CH3 ② CH=CH2 ③
CH=CH2 ③ NO2
NO2④
 OH ⑤
OH ⑤ ⑥
⑥
| A. | ③④ | B. | ②⑤ | C. | ①②⑤⑥ | D. | ②③④⑤⑥ |
19.下列属于既有极性键、又有非极性键、σ键和π键的非极性分子是( )
| A. | H2O2 | B. | N2 | C. | C2H4 | D. | BeCl2 |
3.下列属于水解反应且正确的是( )
| A. | Fe3++3H2O═Fe(OH)3+3H+ | B. | Br-+H2O?HBr+OH- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | NH4++H2O?NH3•H2O+H+ |


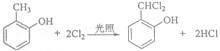 .
. (写结构简式).
(写结构简式).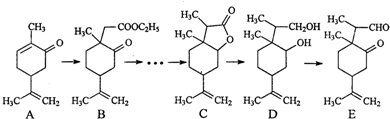
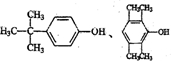 (任写一种).
(任写一种). 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中有氧官能团的名称为醛基.
中有氧官能团的名称为醛基.