题目内容
在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2?2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06mol/L,c(NO)=0.24mol/L.试求:
(1)NO2的转化率为多少?
(2)反应前后的压强比为多少?
(3)在这5分钟内,用O2来表示的平均反应速率是多少?
(1)NO2的转化率为多少?
(2)反应前后的压强比为多少?
(3)在这5分钟内,用O2来表示的平均反应速率是多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,
2NO2 ?2NO+O2
起始量(mol/L) 0.3 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L) 0.06 0.24 0.12
依据列式计算结果分析计算问题;
(1)转化率=
计算;
(2)压强之比等于气体物质的量之比;
(3)反应速率V=
计算;
2NO2 ?2NO+O2
起始量(mol/L) 0.3 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L) 0.06 0.24 0.12
依据列式计算结果分析计算问题;
(1)转化率=
| 消耗量 |
| 起始量 |
(2)压强之比等于气体物质的量之比;
(3)反应速率V=
| △c |
| △t |
解答:
解:依据化学平衡三段式列式计算,
2NO2 ?2NO+O2
起始量(mol/L) 0.3 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L) 0.06 0.24 0.12
(1)NO2的转化率=
×100%=
×100%=80%,答:NO2的转化率为80%;
(2)压强之比等于气体物质的量之比,P前:P后=n前:n后=0.3:(0.06+0.24+0.12)=0.3:0.42=5:7,答:反应前后的压强比为5:7;
(3)在这5分钟内,用O2来表示的平均反应速率V=
=
=0.024mol/L?min,答:用O2来表示的平均反应速率0.024mol/L?min;
2NO2 ?2NO+O2
起始量(mol/L) 0.3 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L) 0.06 0.24 0.12
(1)NO2的转化率=
| 消耗量 |
| 起始量 |
| 0.24mol/L |
| 0.3mol/L |
(2)压强之比等于气体物质的量之比,P前:P后=n前:n后=0.3:(0.06+0.24+0.12)=0.3:0.42=5:7,答:反应前后的压强比为5:7;
(3)在这5分钟内,用O2来表示的平均反应速率V=
| △c |
| △t |
| 0.12mol/L |
| 5min |
点评:本题考查了化学平衡计算分析,主要是转化率、反应速率概念的计算应用,气体压强之比等于气体物质的量之比,题目较简单.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列物质的熔点或液化温度由高到低顺序的是( )
| A、金刚石>晶体硅>碳化硅 |
| B、HBr>HCl>HF |
| C、NaF>NaCl>NaBr |
| D、纯镁>镁铝合金>纯铝 |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,16g氧气中所含的原子数为NA |
| B、0.1mol H2O和D2O组成的混合物中含有的中子数是NA |
| C、1mol CH3+(碳正离子)中含有电子数为10NA |
| D、0.1L 2 mol?L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
 )的路线如图所示:
)的路线如图所示: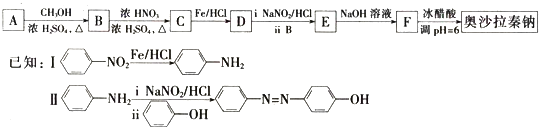
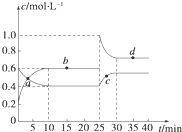 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.