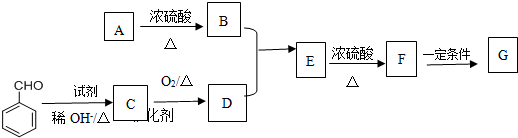
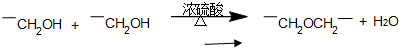
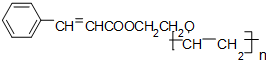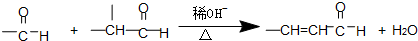题目内容
下列物质的熔点或液化温度由高到低顺序的是( )
| A、金刚石>晶体硅>碳化硅 |
| B、HBr>HCl>HF |
| C、NaF>NaCl>NaBr |
| D、纯镁>镁铝合金>纯铝 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系
专题:化学键与晶体结构
分析:A.原子晶体中,键长越小,键能越大,熔点越高;
B.HF存在氢键,沸点较高;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
D.金属晶体中,电荷越高,离子半径越小,熔点高,且合金比其各成分的熔点都低.
B.HF存在氢键,沸点较高;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
D.金属晶体中,电荷越高,离子半径越小,熔点高,且合金比其各成分的熔点都低.
解答:
解:A.原子晶体的组成元素的原子半径越小,键能越大,熔沸点越高,则应有金刚石>碳化硅>晶体硅,故A错误;
B.HF存在氢键,沸点最高,顺序应为HF>HBr>HCl,故B错误;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,为NaF>NaCl>NaBr,故C正确;
D.金属晶体中,电荷越高,离子半径越小,熔点高,且合金比其各成分的熔点都低,则熔点为纯铝>纯镁>镁铝合金,故D错误.
故选C.
B.HF存在氢键,沸点最高,顺序应为HF>HBr>HCl,故B错误;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,为NaF>NaCl>NaBr,故C正确;
D.金属晶体中,电荷越高,离子半径越小,熔点高,且合金比其各成分的熔点都低,则熔点为纯铝>纯镁>镁铝合金,故D错误.
故选C.
点评:本题考查晶体的熔沸点的比较,题目难度中等,本题注意判断晶体的类型以及影响晶体熔沸点高低的因素,学习中注意相关知识的积累.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、电解质属于化合物 |
| B、可用丁达尔效应来区分溶液和胶体 |
| C、可将碘水中的碘单质萃取出来的试剂的密度必须比水的密度大 |
| D、一些能源比较丰富而淡水短缺的国家,常利用蒸馏法将海水淡化为可饮用水 |
下列各组物质不属于同分异构体的是( )
| A、2-甲基-2-丁烯和环戊烷 |
| B、2-甲基-1,3-丁二烯和1-戊炔 |
| C、2-丁醇和2-甲基-2-丙醇 |
D、 和 和 |
下列元素均位于第ⅦA族,其中非金属性最弱的元素是( )
| A、F | B、Cl | C、Br | D、I |
下列化学用语正确的是( )
A、原子核内有10个中子的氧原子:
| ||
B、CCl4的电子式: | ||
C、CH4分子的比例模型: | ||
D、乙醇的结构式: |
下列离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、澄清石灰水跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、铁粉投入到硫酸铜溶液中:Fe+Cu2+═Fe2++Cu |
 符合如图所示关系的D有几种( )
符合如图所示关系的D有几种( )| A、1 | B、2 | C、3 | D、4 |