题目内容
2.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol.
(2)已知:C(s)+O2(g)═CO2(g);△H=-437.3 kJ•mol-1
H2(g)+O2(g)═H2O(g);△H=-285.8 kJ•mol-1
CO(g)+O2(g)═CO2(g);△H=-283.0 kJ•mol-1
则煤气化反应C(s)+H2O(g)═CO(g)+H2(g) 的焓变△H=+131.5kJ•mol-1.
(3)如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.
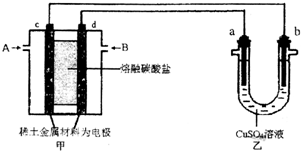
①装置中气体A为CH4(填“CH4”或“O2和CO2”),d极上的电极反应式为O2+4e-+2CO2=2CO32-.
②乙装置中a极上的电极反应式为4OH--4e-=O2↑+2H2O.若在a极产生112mL(标准状况)气体,则甲装置中消耗CH456mL(标准状况),乙装置中所得溶液的pH=1.(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO3溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4•10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为$\frac{w×\frac{142}{322}}{w+18a}$×100%(用含w、a的表达式表示,不必化简).
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关;
(3)①b电极上有红色物质生成,则b是阴极,所以a是阳极,c是负极、d是正极,通入甲烷的电极是负极,所以A是甲烷、B是二氧化碳和氧气,d电极上氧气得电子和二氧化碳反应生成碳酸根离子;
②a是阳极,阳极上氢氧根离子放电生成氧气;
根据转移电子相等计算消耗甲烷体积;根据氧气和氢离子之间的关系式计算氢离子物质的量浓度,从而确定pH;
③电解饱和硫酸钠溶液时,阳极上析出氧气、阴极上析出氢气,所以相当于电解水,且生成氢气和氧气的物质的量之比是2:1,所以当阴极上有a mol气体生成时,阳极上生成氧气物质的量为0.5amol,电解水的质量=amol×2g/mol+0.5amol×32g/mol=18ag,剩余溶液仍然是饱和溶液,计算生成m(Na2SO4),带入质量分数公式计算溶液质量分数.
解答 解:(1)16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol;
(2)已知:C(s)+O2(g)═CO2(g);△H=-437.3 kJ•mol-1
H2(g)+O2(g)═H2O(g);△H=-285.8 kJ•mol-1
CO(g)+O2(g)═CO2(g);△H=-283.0 kJ•mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1,
故答案为:+131.5;
(3)①b电极上有红色物质生成,则b是阴极,所以a是阳极,c是负极、d是正极,通入甲烷的电极是负极,所以A是CH4、B是二氧化碳和氧气,d电极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:CH4;O2+4e-+2CO2=2CO32-;
②a是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O;
a极上生成n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,生成0.005mol氧气转移电子物质的量=0.005mol×4=0.02mol,根据转移电子相等计算消耗甲烷体积=$\frac{0.02mol}{8}$×22.4L/mol=56mL;
电池反应式为2Cu2++2H2O=4 H++O2↑+2Cu,根据方程式知,n( H+)=4n(O2)=4×0.005mol=0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,则溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O;56;1;
③电解饱和硫酸钠溶液时,阳极上析出氧气、阴极上析出氢气,所以相当于电解水,且生成氢气和氧气的物质的量之比是2:1,所以当阴极上有a mol气体生成时,阳极上生成氧气物质的量为0.5amol,电解水的质量=amol×2g/mol+0.5amol×32g/mol=18a g,
剩余溶液仍然是饱和溶液,生成m(Na2SO4)=wg×$\frac{142}{322}$,
溶液质量分数=$\frac{wg×\frac{142}{322}}{wg+18ag}$×100%=$\frac{w×\frac{142}{322}}{w+18a}$×100%,
故答案为:$\frac{w×\frac{142}{322}}{w+18a}$×100%.
点评 本题考查热化学反应方程式的书写、原电池和电解池原理及质量分数有关计算,侧重考查学生分析计算能力,明确各个电极上发生的反应结合转移电子相等进行有关计算,难点是(3)③计算,利用析出晶体与电解水计算溶液质量分数即可,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | K2$\stackrel{+6}{Mn}$O4 | B. | Na2$\stackrel{+4}{S}$O3 | C. | H$\stackrel{+5}{C}$O3- | D. | $\stackrel{-3}{N}$H4+ |
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2→2HCN+CO32- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
| A. | 乙烯通入酸性高锰酸钾溶液中 | |
| B. | 光照射甲烷与氯气的混合气体 | |
| C. | 在镍作催化剂的条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
| A. | 0.25mol | B. | 0.30mol | C. | 0.35mol | D. | 0.4mol |
①
 ②
② ③
③ ④
④
| A. | 0种 | B. | 1种 | C. | 2种 | D. | 3种 |
| A. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) | |
| B. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) |
| A. | 常温下都能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快地反应 | |
| D. | 露置在空气中,容器内溶质的浓度都升高 |
| A. |  | B. |  | C. |  | D. |  |