题目内容
工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如图1:
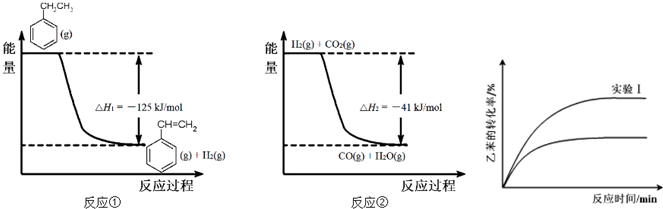
(1)总反应 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)的△H= .
(g)+CO(g)+H2O(g)的△H= .
(2)下列叙述不能说明反应体系已达到平衡状态的是 (填字母).
a.v正(CO)=v逆(CO) b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成1mol H2O d.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应( )的影响,并设计了如下实验:
)的影响,并设计了如下实验:
①乙苯脱氢反应的化学平衡常数表达式为 .
②经实验测得,三组实验中乙苯的转化随时间变化如上图所示.其中未知曲线代表的是实验 (填“Ⅱ”或“Ⅲ”).请用平衡移动原理解释该条件改变对乙苯转化率产生影响的原因: .

(1)总反应
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)的△H=
(g)+CO(g)+H2O(g)的△H=(2)下列叙述不能说明反应体系已达到平衡状态的是
a.v正(CO)=v逆(CO) b.c(CO2)=c(CO)
c.消耗1mol CO2同时生成1mol H2O d.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应(
 )的影响,并设计了如下实验:
)的影响,并设计了如下实验:| 试验编号 | 乙苯 | CO(g)/mol | H(g)/mol | 温度/℃ |
| Ⅰ | 3.0 | 9.0 | 0 | 550 |
| Ⅱ | 3.0 | 9.0 | 0 | 600 |
| Ⅲ | 3.0 | 0 | 9.0 | 550 |
②经实验测得,三组实验中乙苯的转化随时间变化如上图所示.其中未知曲线代表的是实验
考点:有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据盖斯定律结合热化学方程式分析;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(3)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②根据实验目的是探究CO2用量和温度条件对乙苯脱氢反应的影响来回答.
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(3)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②根据实验目的是探究CO2用量和温度条件对乙苯脱氢反应的影响来回答.
解答:
解:(1)根据盖斯定律,反应①+②得到: (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g),所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol,
(g)+CO(g)+H2O(g),所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol,
故答案为:-166 kJ/mol;
(2)A.v正(CO)=v逆(CO),即正逆反应速率相等,所以达到了化学平衡状态,故A错误;
B.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故B正确;
C.消耗1mol CO2同时生成1mol H2O,只能表示反应的正方向速率,不能说明正逆反应速率相等,故C正确;
D.反应前后气体物质的量改变,但质量守恒,所以混合气体的平均相对分子质量会改变,则当平均相对分子质量不变化,证明达到了平衡,故D错误;
故选BC;
(3)①化学反应的平衡常数表达K=
,故答案为:K=
;
②根据图2所示.未知曲线中,乙苯的转化率降低,化学反应逆向移动,实验Ⅲ符合图示信息,对于平衡: ,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高,
,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高,
故答案为:Ⅲ;对于平衡: ,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高.
,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高.
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g),所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol,
(g)+CO(g)+H2O(g),所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol,故答案为:-166 kJ/mol;
(2)A.v正(CO)=v逆(CO),即正逆反应速率相等,所以达到了化学平衡状态,故A错误;
B.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故B正确;
C.消耗1mol CO2同时生成1mol H2O,只能表示反应的正方向速率,不能说明正逆反应速率相等,故C正确;
D.反应前后气体物质的量改变,但质量守恒,所以混合气体的平均相对分子质量会改变,则当平均相对分子质量不变化,证明达到了平衡,故D错误;
故选BC;
(3)①化学反应的平衡常数表达K=
| c(苯乙烯)?c(H2) |
| c(乙苯) |
| c(苯乙烯)?c(H2) |
| c(乙苯) |
②根据图2所示.未知曲线中,乙苯的转化率降低,化学反应逆向移动,实验Ⅲ符合图示信息,对于平衡:
 ,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高,
,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高,故答案为:Ⅲ;对于平衡:
 ,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高.
,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高.
点评:本题综合性较大,涉及化学平衡状态的判断、盖斯定律、化学平衡、平衡常数等知识,注意知识的归纳和整理是关键,难度大.

练习册系列答案
相关题目
若氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A、该氖原子的相对原子质量是
| ||
| B、该氖原子的摩尔质量是aNAg | ||
C、Wg该氖原子的物质的量是
| ||
D、Wg该氖原子所含质子数是
|
现有钠、镁、铝各1mol,分别与100mL 5.0mol/L盐酸充分反应后,所得同温、同压下的H2体积关系正确的是( )
| A、产生H2体积相等 |
| B、铝产生H2最多,钠产生H2最少 |
| C、钠产生H2最多,铝产生H2最少 |
| D、钠产生H2最多,镁、铝产生H2相等 |
 有A、B、C、D四中元素,其中A的基态原子核外电子有11中运动状态,B的基态原子得一个电子喉3p轨道就处于全充满状态,C的最常见气态氢化物呈碱性,D与A能形成离子化合物A2D且D2-比A+多一个电子层.
有A、B、C、D四中元素,其中A的基态原子核外电子有11中运动状态,B的基态原子得一个电子喉3p轨道就处于全充满状态,C的最常见气态氢化物呈碱性,D与A能形成离子化合物A2D且D2-比A+多一个电子层.