题目内容
可逆反应N2(g)+3H2(g)?2NH3(g)在一定条件下于10L的密闭容器中发生,若开始时加入2molN2、2molH2、0mol NH3,反应达到平衡时NH3的浓度不可能达到的值是( )
| A、0.1mol/L |
| B、0.02mol/L |
| C、0.05mol/L |
| D、0.15mol/L |
考点:化学反应的可逆性
专题:化学平衡专题
分析:可逆反应不能进行到底,利用极限转化法计算出氨气的最大浓度即可解答.
解答:
解:该反应为可逆反应,可逆反应不能进行到底.假设反应完全进行,由化学方程式 N2(g)+3H2(g)?2NH3(g),知2molN2 过量,因而2molH2 完全反应生成
mol NH3,故NH3的浓度肯定小于
=0.13mol/L,不可能达到0.15mol?L-1,
故选D.
| 4 |
| 3 |
| ||
| 10L |
故选D.
点评:本题考查可逆反应的特点,难度不大,掌握化学方程式相关的计算是解题的关键.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
同主族两种元素原子的核外电子数差值可能为( )
| A、6 | B、12 | C、18 | D、30 |
下列做法存在安全隐患或导致实验失败的是( )
| A、将1mol?L-1 FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B、氢气还原氧化铜实验中,先通氢气后加热氧化铜 |
| C、将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液 |
| D、用烧瓶加热液体时投入碎瓷片以防暴沸 |
将颜色相近的NO2和Br2(g)分别装入注射器中,将活塞同时向外拉使气体体积扩大一倍,对颜色变化叙述正确的是( )
| A、两注射器中颜色跟原来一样 |
| B、两注射器中颜色比原来深 |
| C、盛NO2注射器中颜色比盛Br2(g)注射器中颜色浅 |
| D、盛NO2注射器中颜色比盛Br2(g)注射器中颜色深 |
如表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、W元素的氢化物分子间有氢键 |
| B、Z和X能以共价键结合形成一种无机非金属材料 |
| C、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 |
| D、X元素的非金属性比Y元素非金属性强 |
下列离子方程式正确的是( )
| A、碳酸氢钠水解:HCO3-+H2O?H3O++CO32- |
| B、醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O |
| C、硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) |
钠在自然界中最主要的存在形式是( )
| A、游离态 | B、氯化钠 |
| C、硫酸钠 | D、硝酸钠 |
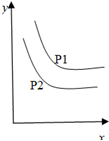 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应是放热反应 |
| B、a=b |
| C、a>b |
| D、上述反应是吸热反应 |
下列离子方程式正确的是( )
| A、锌粉与稀硝酸反应:Zn+2H+═Zn2++H2↑ | ||||
B、硫酸铵中NH4+的检验:NH4++OH-
| ||||
| C、NH4Al(SO4)2溶液与足量Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|