题目内容
20. 维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A. | 维生素C与足量金属钠反应产生氢气是维生素C物质的量的4倍 | |
| B. | 维生素C因为含有酯基而难溶于水 | |
| C. | 维生素C中含有醚键 | |
| D. | 维生素C的酸性可能是③、④两个羟基引起的 |
分析 由结构可知,分子中含-OH、碳碳双键、-COOC-,结合醇、烯烃、酯的性质来解答.
解答 解:A.含4个-OH与Na反应,则维生素C与足量金属钠反应产生氢气是维生素C物质的量的2倍,故A错误;
B.含多个羟基,易与水形成氢键,可溶于水,故B错误;
C.不含醚键,故C错误;
D.与双键相连的-OH不稳定,则维生素C的酸性可能是③、④两个羟基引起的,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查醇、酯的性质,注意选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
8.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  实验室制取乙烯 | B. | 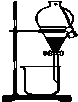 利用酒精萃取碘水中的I2单质 | ||
| C. | 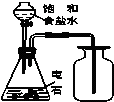 实验室制取乙炔并收集 | D. | 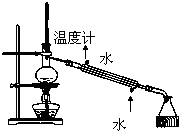 石油的分馏实验 |
15.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(1)所示,若保持其他条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图(2)所示,则下列结论正确的是( )
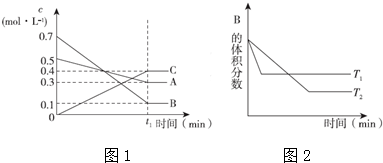

| A. | 该平衡体系的化学反应方程式为:3A(g)+B(g)═4 C(g) | |
| B. | 在t1时间内用B表示该反应的平均速率为0.6/t1mol•L-1•min-1 | |
| C. | 其他条件不变,升高温度,正反应速率减小、逆反应速率增大,A的转化率减小 | |
| D. | 维持温度和容器体积不变,往平衡体系中充惰性气体,C的百分含量增大 |
5.已知反应A(g)+3B(g)?2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
12.电解100mlpH=1的下列溶液,当电路中通过0.02mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
9.CO是甲酸(HCOOH)的酸酐,将甲酸与下列某物质混合可制取CO,该物质是( )
| A. | 浓硫酸 | B. | 碳粉 | C. | NaOH固体 | D. | Na2O2粉末 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐Na4S2O3,在酸性条件下可以产生S.下列关于混盐
Na4S2O3的有关判断不正确的是( )
Na4S2O3的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
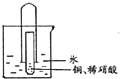 为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答:
为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答: