题目内容
1.下列陈述Ⅰ、Ⅱ正确且有因果关系的是( )| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2有漂白作用 | Cl2能使湿润的有色布条褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | 浓氨汽化时要吸收大量的热 | 浓氨可用作制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气无漂白性,氯气和水反应生成次氯酸具有漂白性;
B.SiO2有光导性,不能导电;
C.浓硫酸的吸水性是做干燥剂的原因;
D.液氨汽化时要吸收大量的热.
解答 解:A.氯气无漂白性,氯气和水反应生成次氯酸具有漂白性,Cl2能使湿润的有色布条褪色,陈述Ⅰ错误,二者无因果关系,故A错误;
B.二氧化硅无导电性,SiO2可用于制备光导纤维是利用二氧化硅晶体对光的传导作用,陈述Ⅰ错误,二者无因果关系,故B错误;
C.浓硫酸的吸水性,浓硫酸可用于干燥H2和CO,二者无因果关系,故C错误;
D.液氨汽化时要吸收大量的热,可用作制冷剂,故D正确;
故选D.
点评 本题考查了物质性质和应用,主要是氯气、二氧化硅、浓硫酸、液氨等物质的性质理解应用,题目较简单.

练习册系列答案
相关题目
12.电解100mlpH=1的下列溶液,当电路中通过0.02mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10mol•L-1Ag+ | B. | 0.20mol•L-1Zn2+ | C. | 0.20mol•L-1Cu2+ | D. | 0.20mol•L-1Pb2+ |
9.CO是甲酸(HCOOH)的酸酐,将甲酸与下列某物质混合可制取CO,该物质是( )
| A. | 浓硫酸 | B. | 碳粉 | C. | NaOH固体 | D. | Na2O2粉末 |
16.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 22.4L氯气与足量的钠反应,转移的电子数为2NA | |
| B. | 常温常压下,32gO3或O2中含有的氧原子数都为2NA | |
| C. | 1 mol氯气与足量水反应时,转移的电子数为2NA | |
| D. | 含2 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为2NA |
13.下列说法中,正确的是( )
| A. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| B. | 人们可以利用化学变化制造出新的分子和原子 | |
| C. | 门捷列夫提出的原子学说,为现代化学的发展奠定了坚实的基础 | |
| D. | 化学科学在未来还将继续推动材料科学的发展,使各种新功能材料的生产成为可能 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐Na4S2O3,在酸性条件下可以产生S.下列关于混盐
Na4S2O3的有关判断不正确的是( )
Na4S2O3的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
11.下列实验对应的现象与结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将浓硫酸入蔗糖中 | 固体变黑后发生膨胀 | 浓硫酸具有吸水性和强还原性 |
| B | 将两小粒相同的钠分别投入乙醇和水中 | 钠在水中反应比在乙醇中剧烈 | 相同条件下,水的电离能力比乙醇强 |
| C | 向某溶液滴加氯水后再滴入KCSN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 常温时将铝片加入浓硝酸中 | 未出现气泡 | 常温下铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
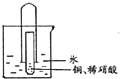 为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答:
为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答: