题目内容
如图列出了①~⑨九种元素在周期表中的位置.请按要求回答下列问题.

(1)这九种元素中,原子半径最大的是(填元素符号) ;元素⑤的原子结构示意图为 .
(2)⑧、⑥两种元素最高价氧化物对应的水化物中,酸性较弱的是(填化学式) .
(3)③、④、⑤三种元素的气态氢化物中,稳定性最弱的是(填化学式) .
(4)写出元素②的单质与水反应的化学方程式: .
(5)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式: .

(1)这九种元素中,原子半径最大的是(填元素符号)
(2)⑧、⑥两种元素最高价氧化物对应的水化物中,酸性较弱的是(填化学式)
(3)③、④、⑤三种元素的气态氢化物中,稳定性最弱的是(填化学式)
(4)写出元素②的单质与水反应的化学方程式:
(5)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素周期表知,①是H元素、②是Li元素、③是C元素、④是N元素、⑤是F元素、⑥是Si元素、⑦是Cl元素、⑧是K元素、⑨是Br元素,利用元素、单质、化合物的性质及元素周期律来分析解答.
(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大;
(2)同主族,从上到下,元素的非金属性随着电子层数的增大而减小,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)同周期从左到右,非金属性增强,气态氢化物的稳定性增强;
(4)锂和水反应生成氢氧化锂和氢气;
(5)Cl的非金属性强于Br,故Cl2可把Br从化合物中置换出来.
(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大;
(2)同主族,从上到下,元素的非金属性随着电子层数的增大而减小,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)同周期从左到右,非金属性增强,气态氢化物的稳定性增强;
(4)锂和水反应生成氢氧化锂和氢气;
(5)Cl的非金属性强于Br,故Cl2可把Br从化合物中置换出来.
解答:
解:根据元素周期表知,①是H元素、②是Li元素、③是C元素、④是N元素、⑤是F元素、⑥是Si元素、⑦是Cl元素、⑧是K元素、⑨是Br元素.
(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大,故这九种元素中,原子半径最大的是K;F的原子结构示意图为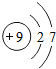 ,
,
故答案为:K;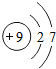 ;
;
(2)同主族,从上到下,元素的非金属性随着电子层数的增大而减小,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以这2种元素中,非金属性C的强于Si,故酸性硅酸弱,故答案为:H2SiO3;
(3)同周期从左到右,非金属性增强,气态氢化物的稳定性增强,故③、④、⑤三种元素的气态氢化物中,稳定性最弱的是CH4,
故答案为:CH4;
(4)锂和水反应生成氢氧化锂和氢气,方程式为:2Li+2H2O=2LiOH+H2↑,故答案为:2Li+2H2O=2LiOH+H2↑;
(5)Cl的非金属性强于Br,故Cl2可把Br从化合物中置换出来,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-.
(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大,故这九种元素中,原子半径最大的是K;F的原子结构示意图为
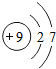 ,
,故答案为:K;
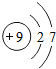 ;
;(2)同主族,从上到下,元素的非金属性随着电子层数的增大而减小,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以这2种元素中,非金属性C的强于Si,故酸性硅酸弱,故答案为:H2SiO3;
(3)同周期从左到右,非金属性增强,气态氢化物的稳定性增强,故③、④、⑤三种元素的气态氢化物中,稳定性最弱的是CH4,
故答案为:CH4;
(4)锂和水反应生成氢氧化锂和氢气,方程式为:2Li+2H2O=2LiOH+H2↑,故答案为:2Li+2H2O=2LiOH+H2↑;
(5)Cl的非金属性强于Br,故Cl2可把Br从化合物中置换出来,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-.
点评:本题考查位置、结构、性质的关系的应用,根据元素在周期表中的位置确定元素或根据元素周期律来比较元素所具有的性质,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、能电离出氢离子的化合物叫做酸 |
| B、能电离出氢氧根离子的化合物叫做碱 |
| C、能电离出酸根离子的化合物叫做盐 |
| D、由金属离子和酸根离子组成的化合物属于盐 |
下列有关反应的离子方程式正确的是( )
| A、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O | ||||
B、偏铝酸钠溶液与适量醋酸反应:AlO
| ||||
C、氨气通入稀硫酸溶液中:2NH3+H2SO4=2NH
| ||||
| D、向氢硫酸中通入适量氯气:S2-+Cl2=S↓+2Cl- |