题目内容
NCl3是一种淡黄色的油状液体,测得其分子具有三角锥形结构,下列对NCl3的有关描述中正确的是( )
| A、它是一种非极性分子 |
| B、它还能以配位键跟Cl-结合 |
| C、它的沸点比PCl3更高 |
| D、已知NBr3对光很敏感,故NCl3也具有光敏性 |
考点:配合物的成键情况,“等电子原理”的应用,极性分子和非极性分子
专题:化学键与晶体结构
分析:A.正负电荷中心重合的分子为非极性分子,正负电荷中心不重合的分子为极性分子;
B.含有孤电子对和含有空轨道的原子之间易形成配位键;
C.结构相似分子晶体中,其熔沸点与相对分子质量成正比;
D.等电子体结构和性质相似.
B.含有孤电子对和含有空轨道的原子之间易形成配位键;
C.结构相似分子晶体中,其熔沸点与相对分子质量成正比;
D.等电子体结构和性质相似.
解答:
解:A.NCl3分子具有锥形结构,正负电荷中心不重合,所以其为极性分子,故A错误;
B.NCl3的电子式为 ,Cl-的电子式
,Cl-的电子式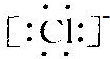 ,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;
,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;
C.NCl3和PCl3结构相似,且都是分子晶体,NCl3的相对分子质量比PCl3的小,故其沸点不可能比PCl3高,故D错误;
D.NCl3和PCl3是等电子体,二者结构和性质相似,NBr3对光很敏感,则NCl3也具有光敏性,故D正确;
故选D.
B.NCl3的电子式为
 ,Cl-的电子式
,Cl-的电子式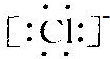 ,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;
,由两者的电子式知,N、Cl两原子的最外层都达8电子稳定结构,故不可能形成配位键,故B错误;C.NCl3和PCl3结构相似,且都是分子晶体,NCl3的相对分子质量比PCl3的小,故其沸点不可能比PCl3高,故D错误;
D.NCl3和PCl3是等电子体,二者结构和性质相似,NBr3对光很敏感,则NCl3也具有光敏性,故D正确;
故选D.
点评:本题以NCl3为载体考查分子极性判断、配位键的形成、等电子体等知识点,为高考高频点,明确分子结构、等电子体理论、配位键的形成条件等即可解答,还常常考查等电子体的书写,题目难度不大.

练习册系列答案
相关题目
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)?2NH3(g)△H<0,相关数据如下表所示:下列说法正确的是 ( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A、0.1 mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA |
| C、0.l mol O3和O2的混合气体中含氧原子数目为0.2NA |
| D、0.1 mol NA完全被氧化生成Na2O2,转移电子的数目为0.1NA |
含铀矿物通常用铅(Pb)的同位素测年法进行断代,下列关于
Pb和
Pb说法正确的是( )
206 82 |
207 82 |
| A、含不同的质子数 |
| B、含不同的电子数 |
| C、含相同的中子数 |
| D、互相转化时不属于化学变化 |
通常状况下,下列物质所占体积最大的是( )
| A、508gI2 |
| B、16gO2 |
| C、32gHCl |
| D、3gH2 |
下列说法正确的是( )
| A、Fe和Mg与0.1 mol?L-1的盐酸反应,反应速率相同 |
| B、0.1 mol?L-1的盐酸与0.1 mol?L-1 H2SO4分别与大小、形状相同的大理石反应,反应速率相同 |
| C、催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |
| D、100 mL 2 mol?L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、OH-、NO3- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
 如图周期表中短周期元素的一部分,已知A和B原子核质子数均均与中子数相等,且A2的分子量等于B的原子量.
如图周期表中短周期元素的一部分,已知A和B原子核质子数均均与中子数相等,且A2的分子量等于B的原子量.