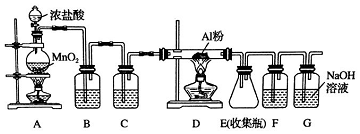
题目内容
8.同温、同压下,质量相等的SO2和CO2相比较,体积之比为11:16,已知SO2和CO2均为酸性氧化物,写出SO2与足量NaOH溶液反应的化学方程式SO2+2NaOH-=Na2SO3+H2O.分析 依据n=$\frac{m}{M}$=$\frac{V}{Vm}$,结合同温同压下,气体体积之比等于物质的量之比解答;
二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水;
解答 解:依据n=$\frac{m}{M}$=$\frac{V}{Vm}$,质量相等的SO2和CO2物质的量之比为:44:64=11:16;同温、同压下,体积之比为:11:16,
二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2NaOH-=Na2SO3+H2O,
故答案为:11:16;SO2+2NaOH-=Na2SO3+H2O.
点评 本题考查了有关物质的量计算和离子方程式的书写,熟悉以物质的量为核心的计算公式,明确二氧化硫的性质是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列说法正确的是( )
| A. | Al2O3固体不导电且难溶于水,所以Al2O3不是电解质 | |
| B. | Na2SO4溶液导电,所以Na2SO4是电解质 | |
| C. | 纯净的硫酸不导电,所以硫酸不是电解质 | |
| D. | 1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强 |
20.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | SO2>I->Fe2+ | B. | I->Fe2+>SO2 | C. | Fe2+>I->SO2 | D. | Fe2+>SO2>I- |
17.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是( )
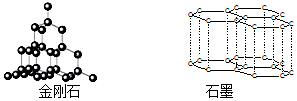
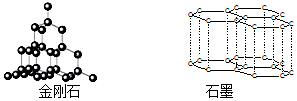
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
18.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 食盐溶于水 | B. | 碳酸氢钠溶于水 | C. | 将HCl通入水中 | D. | 氯化铵受热分解 |
 .
.