题目内容
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:
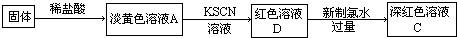
(1)甲同学认为:该黑色固体为四氧化三铁.请写出黑色固体溶于稀盐酸的化学方程式;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是;
(3)深红色溶液C放置一段时间后,发现红色褪去.关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN-氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol?L-1 HNO3、1.0mol?L-1盐酸、1.0mol?L-1 NaOH、0.lmol?L-1 FeC13、0.lmol?L-1 CuSO4、20%KSCN、蒸馏水.
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色.由此她认为生成该固体的化学方程式为 .
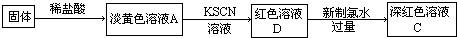
(1)甲同学认为:该黑色固体为四氧化三铁.请写出黑色固体溶于稀盐酸的化学方程式;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是;
(3)深红色溶液C放置一段时间后,发现红色褪去.关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN-氧化;
假设二:空气中有还原性物质,将
假设三:氯水有极强的氧化性,将
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol?L-1 HNO3、1.0mol?L-1盐酸、1.0mol?L-1 NaOH、0.lmol?L-1 FeC13、0.lmol?L-1 CuSO4、20%KSCN、蒸馏水.
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | 说明假设一是合理的 |
考点:铁及其化合物的性质实验
专题:实验设计题
分析:(1)四氧化三铁与盐酸反应生成氯化铁和氯化亚铁、水;
(2)根据上述实验现象可以判断得到的产物中应含有二价铁、和三价铁离子,而黑色固体如果为Fe3O4和FeO或Fe3O4和Fe或Fe3O4、FeO和Fe时都能够保证溶与盐酸含有二价铁和三价铁离子;
(3)显红色的是三价铁离子与硫氰根离子的络合物,三价铁具有强的还原性、氯水具有强的氧化性,通过反应消耗三价铁或者硫氰根离子,据此解答;
硫氰根离子与三价铁离子发生络合反应,生成血红色物质,如果假设1成立,则溶液中仍然存在三价铁离子,重新加入硫氰根离子,又会与三价铁反应显血红色,或者再加入三价铁离子看溶液是否显血红色,证明褪色不是因为三价铁消耗的原因,据此解答.
(4)依据铁与水蒸气反应的实验得到的黑色固体的性质排除三氧化二铁和四氧化三铁.
(2)根据上述实验现象可以判断得到的产物中应含有二价铁、和三价铁离子,而黑色固体如果为Fe3O4和FeO或Fe3O4和Fe或Fe3O4、FeO和Fe时都能够保证溶与盐酸含有二价铁和三价铁离子;
(3)显红色的是三价铁离子与硫氰根离子的络合物,三价铁具有强的还原性、氯水具有强的氧化性,通过反应消耗三价铁或者硫氰根离子,据此解答;
硫氰根离子与三价铁离子发生络合反应,生成血红色物质,如果假设1成立,则溶液中仍然存在三价铁离子,重新加入硫氰根离子,又会与三价铁反应显血红色,或者再加入三价铁离子看溶液是否显血红色,证明褪色不是因为三价铁消耗的原因,据此解答.
(4)依据铁与水蒸气反应的实验得到的黑色固体的性质排除三氧化二铁和四氧化三铁.
解答:
解:(1)四氧化三铁与盐酸反应生成氯化铁和氯化亚铁、水,化学方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)通过上述实验现象只能说明生成的物质中同时含有三价铁和二价铁,可能的情况有:黑色固体为Fe3O4,或者是Fe3O4和FeO,或者是Fe3O4和Fe,或者是Fe3O4、FeO和Fe,几种情况都有可能;
故答案为:该黑色固体不一定仅仅是Fe3O4,当黑色固体为Fe3O4和FeO或Fe3O4和Fe或Fe3O4、FeO和Fe时,也都有上述现象;
(3)显红色的是三价铁离子与硫氰根离子的络合物,三价铁具有强的还原性、氯水具有强的氧化性,通过反应消耗三价铁或者硫氰根离子,所以可能是:氯水有强氧化性,将溶液中的SCN-氧化;或者是空气中有还原性物质将溶液中的Fe3+还原为Fe2+;或者是溶液中的+3价铁氧化为更高的价态;
故答案为:溶液中的Fe3+还原为Fe2+;溶液中的+3价铁氧化为更高的价态;
硫氰根离子与三价铁离子发生络合反应,生成血红色物质,如果假设1成立,则溶液中仍然存在三价铁离子,重新加入硫氰根离子,又会与三价铁反应显血红色,或者再加入三价铁离子看溶液是否显血红色,证明褪色不是因为三价铁消耗的原因,
故答案为:
(4)根据题干可知铁与水蒸气反应生成的物质为黑色固体、且不能被磁铁吸引,排除三氧化二铁和四氧化三铁,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色,说明该物质中含有的铁为二价铁,所以铁与水蒸气反应生成的是氧化亚铁和氢气,化学方程式为:Fe+H2O=FeO+H2;
故答案为:Fe+H2O=FeO+H2.
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)通过上述实验现象只能说明生成的物质中同时含有三价铁和二价铁,可能的情况有:黑色固体为Fe3O4,或者是Fe3O4和FeO,或者是Fe3O4和Fe,或者是Fe3O4、FeO和Fe,几种情况都有可能;
故答案为:该黑色固体不一定仅仅是Fe3O4,当黑色固体为Fe3O4和FeO或Fe3O4和Fe或Fe3O4、FeO和Fe时,也都有上述现象;
(3)显红色的是三价铁离子与硫氰根离子的络合物,三价铁具有强的还原性、氯水具有强的氧化性,通过反应消耗三价铁或者硫氰根离子,所以可能是:氯水有强氧化性,将溶液中的SCN-氧化;或者是空气中有还原性物质将溶液中的Fe3+还原为Fe2+;或者是溶液中的+3价铁氧化为更高的价态;
故答案为:溶液中的Fe3+还原为Fe2+;溶液中的+3价铁氧化为更高的价态;
硫氰根离子与三价铁离子发生络合反应,生成血红色物质,如果假设1成立,则溶液中仍然存在三价铁离子,重新加入硫氰根离子,又会与三价铁反应显血红色,或者再加入三价铁离子看溶液是否显血红色,证明褪色不是因为三价铁消耗的原因,
故答案为:
| 实验操作 | 预期现象 | 只答对其中一方面均可得分 |
| 取少量褪色后的溶液,滴加20%KSCN溶液(2分) | 如果溶液变红色(2分) | |
| 或取少量褪色后溶液,加入0.1mol?L-1FeCl3溶液 | 或如果溶液不变红色 |
故答案为:Fe+H2O=FeO+H2.
点评:本题考查了铁及其化合物性质,明确二价铁离子与三价铁离子的性质及检验的方法是解题关键,侧重学生对实验方案设计及评价,题目难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通人空气,将红热的铂丝插人瓶中并接近液面.反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热.下列有关说法错误的是( )
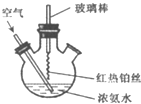

| A、反应后溶液中含有NO3- |
| B、反应后溶液中c(H+)增大 |
| C、实验过程中有化合反应发生 |
| D、实验过程中NH3?H2O的电离常数不可能发生变化 |
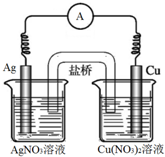 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )| A、向硝酸银溶液中加入氯化钠固体,电流强度会减小 |
| B、向硝酸铜溶液中加入氢氧化钠固体,电流强度会减小 |
| C、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针偏转方向将相反 |
| D、当电流计指针为0时,该反应平衡常数K=0 |
中和热的测定实验中,可能用到下列仪器:①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.其中应使用仪器的正确组合是( )
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
下列有机物的系统命名中正确的是( )
| A、3-甲基-4-乙基戊烷 |
| B、3,3,4-三甲基己烷 |
| C、3-甲基-5-己烯 |
| D、3,5-二甲基己烷 |
 X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表: 下列说法正确的是( )
下列说法正确的是( )