题目内容
18.下列有关热化学方程式的叙述正确的是( )| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ•mol-1 |
分析 A.甲烷燃烧热中生成水为液体;
B.能量低的物质稳定;
C.中和热为△H=-57.4 kJ•mol-1,可知生成1mol时放出的热量为57.4kJ;
D.CO(g)的燃烧热是283.0 kJ•mol-1,则CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283 kJ•mol-1,结合物质的量与热量成正比、可逆反应的焓变数值相同符号相反来解答.
解答 解:A.已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=2CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.已知C(石墨,s)=C(金刚石,s)△H>0,石墨能量低,则金刚石不如石墨稳定,故B错误;
C.中和热为△H=-57.4 kJ•mol-1,可知生成1mol时放出的热量为57.4kJ,则1mol稀硫酸和足量稀NaOH溶液反应生成2mol水,该反应热不是中和热,故C错误;
D.CO(g)的燃烧热是283.0 kJ•mol-1,则CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283 kJ•mol-1,可知2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ•mol-1,故D正确;
故选D.
点评 本题考查热化学方程式,为高频考点,把握热化学方程式的书写、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意焓变的判断,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
3.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
8.下列各组微粒,在溶液中能大量共存的是( )
| A. | Ca2+、Cl-、CO32-、K+ | B. | Cu2+、Cl-、SO42-、OH- | ||
| C. | K+、Cl-、NO3-、H+ | D. | H +、Cl-、CO32-、Na+ |
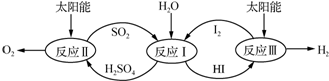
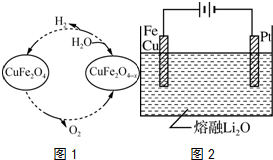
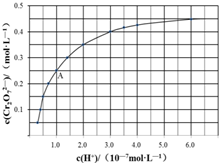 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:



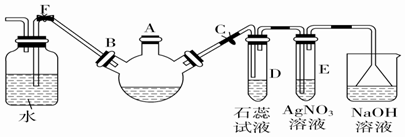
 .
.