题目内容
15.常温下,下列四种溶液中由电离生成的c(H+)之比(①:②:③:④)为( )①1mol/L的盐酸; ②0.1mol/L盐酸; ③0.01mol/L的NaOH溶液; ④1mol/L的NaOH溶液.
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 1:2:12:14 |
分析 电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)×c(OH-)计算该题.
解答 解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①1mol•L-1的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为$\frac{1×1{0}^{-14}}{1}$mol/L=1×10-14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢氧根离子为$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为$\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L;
④1mol/L的NaOH 溶液,溶液中氢离子浓度为1×10-14mol/L;
所以由水电离产生的c(H+)之比①:②:③:④=1×10-14mol/L:1×10-13mol/L:1×10-12mol/L:1×10-14mol/L=1:10:100:1,
故选A.
点评 本题考查了水的电离以及pH的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,解题关键是合理判断酸碱溶液中水电离情况分析及计算方法,注意酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.

练习册系列答案
相关题目
3.下列各组物质中能产生如图现象的是( )


| A. | 浓硝酸与浓氨水 | B. | 浓硫酸与浓氨水 | ||
| C. | 浓盐酸与浓氯化铵溶液 | D. | 浓硝酸与浓氢氧化钠溶液 |
10.Na2O2是中学化学常用试剂,下列说法错误是( )
| A. | 0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.1mol | |
| B. | 将Na2O2粉末加入到饱和NaOH溶液中,OH-离子浓度一定不变 | |
| C. | 等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 | |
| D. | 等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 |
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L SO2和SO3的混合物中硫原子数为0.5NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA | |
| D. | 常温常压下,7.8 g Na2O2含有的阴离子数目为0.1NA |
7.下列说法中不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
10.维生素在人体内起到调节新陈代谢,预防疾病,维护身体健康的作用.患坏血症的人缺乏的维生素是( )
| A. | 维生素D | B. | 维生素C | C. | 维生素B | D. | 维生素A |

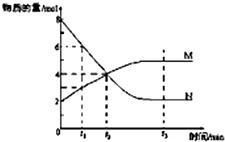 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: