题目内容
在TK、300MPa时,往容积可变的密闭容器中充入 1molN2、3molH2,此时,容器的体积为200L.向容器中加入催化剂(铁触媒)并保持恒温恒压,发生反应:N2 (g)+3H2(g)?2NH3(g),达到平衡时 NH3的体积分数为
.
试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2molNH3,并加入铁触媒催化剂.则平衡时,N2的体积分数是 ,容器的体积为 .
(2)保持上述温度不变,在200L的定容容器中进行合成氨反应,改变起始时原料气的充入量,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应N2(g)+3H2(g)?2NH3(g) V(N2)正 3V(H2)逆(填:“>”、“<”、“=”、“不能确定”)
(3)温度仍保持TK,容器体积保持200L不变(恒容).充入amolN2,bmolH2,并加入铁触媒催化剂,反应达到平衡时,NH3的体积分数仍为
,体系压强为300MPa.若a:b=1:3,则a= mol.
(4)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图.下列说法正确的是 (填序号).
A.图Ⅰ可能是不同催化剂对反应的影响,且催化剂性能 2>1
B.图Ⅱ可能是同温同压下,不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2
| 1 |
| 3 |
试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2molNH3,并加入铁触媒催化剂.则平衡时,N2的体积分数是
(2)保持上述温度不变,在200L的定容容器中进行合成氨反应,改变起始时原料气的充入量,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应N2(g)+3H2(g)?2NH3(g) V(N2)正
(3)温度仍保持TK,容器体积保持200L不变(恒容).充入amolN2,bmolH2,并加入铁触媒催化剂,反应达到平衡时,NH3的体积分数仍为
| 1 |
| 3 |
(4)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图.下列说法正确的是

A.图Ⅰ可能是不同催化剂对反应的影响,且催化剂性能 2>1
B.图Ⅱ可能是同温同压下,不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,设反应的氮气物质的量为x
N2 (g)+3H2(g) 2NH3(g),
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
=
x=0.5
(1)保持上述温度和压强不变,若向容器中只充入2molNH3,并加入铁触媒催化剂.和加入 1molN2、3molH2,达到相同的平衡状态;容器体积之比和气体物质的量之比相同计算;
(2)计算上述温度下的平衡常数,结合浓度商和平衡常数比较分析判断反应进行的方向;
(3)依据平衡状态的体积之比等于物质的量之比;
(4)A.催化剂不影响平衡移动;
B.催化剂不影响平衡移动,改变反应速率;
C.压强不同,平衡状态不同;
D.升高温度平衡逆向移动;
N2 (g)+3H2(g) 2NH3(g),
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
| 2x |
| 4-2x |
| 1 |
| 3 |
x=0.5
(1)保持上述温度和压强不变,若向容器中只充入2molNH3,并加入铁触媒催化剂.和加入 1molN2、3molH2,达到相同的平衡状态;容器体积之比和气体物质的量之比相同计算;
(2)计算上述温度下的平衡常数,结合浓度商和平衡常数比较分析判断反应进行的方向;
(3)依据平衡状态的体积之比等于物质的量之比;
(4)A.催化剂不影响平衡移动;
B.催化剂不影响平衡移动,改变反应速率;
C.压强不同,平衡状态不同;
D.升高温度平衡逆向移动;
解答:
解:(1)保持上述温度和压强不变,若向容器中只充入2molNH3,并加入铁触媒催化剂.和加入 1molN2、3molH2,达到相同的平衡状态,氮气的体积分数=
×100%=16.67%,气体体积之比等于气体物质的量之比,4:200=(4-2×0.5):V
V=150L;
故答案为:16.67%,150;
(2)平衡状态下平衡常数K=
=1.3×105;
浓度商Q=
=80000<K,反应正向进行,
V(N2)正:(H2)正=1:3,(H2)正=3V(N2)正,V(N2)正<3V(H2)逆;
故答案为:<;
(3)温度仍保持TK,容器体积保持200L不变(恒容).充入amolN2,bmolH2,并加入铁触媒催化剂,反应达到平衡时,NH3的体积分数仍为
,体系压强为300MPa,若a:b=1:3,气体体积之比等于气体物质的量之比,开始投入氮气计算 恒容容器中150:1=200:x
x=1.33
故答案为:1.33;
(4)A.催化剂不影响平衡移动,氨气含量不变,由图象可知不符合,故A错误.
B.图Ⅱ可能是同温同压下,不同催化剂对反应的影响,且催化剂性能1>2,故B正确;
C.反应是气体体积变化的反应,改变压强,平衡变化,图Ⅱ不可能是不同压强对反应的影响,故C错误;
D.氨气的含量减小,先拐先平,T1>T2,反应是放热反应,升高温度平衡逆向移动,氨气含量减小,故D错误;
故答案为:B
| 1-0.5 |
| 4-2×0.5 |
V=150L;
故答案为:16.67%,150;
(2)平衡状态下平衡常数K=
(
| ||||
|
浓度商Q=
(
| ||||
|
V(N2)正:(H2)正=1:3,(H2)正=3V(N2)正,V(N2)正<3V(H2)逆;
故答案为:<;
(3)温度仍保持TK,容器体积保持200L不变(恒容).充入amolN2,bmolH2,并加入铁触媒催化剂,反应达到平衡时,NH3的体积分数仍为
| 1 |
| 3 |
x=1.33
故答案为:1.33;
(4)A.催化剂不影响平衡移动,氨气含量不变,由图象可知不符合,故A错误.
B.图Ⅱ可能是同温同压下,不同催化剂对反应的影响,且催化剂性能1>2,故B正确;
C.反应是气体体积变化的反应,改变压强,平衡变化,图Ⅱ不可能是不同压强对反应的影响,故C错误;
D.氨气的含量减小,先拐先平,T1>T2,反应是放热反应,升高温度平衡逆向移动,氨气含量减小,故D错误;
故答案为:B
点评:本题考查了化学平衡,化学反应速率,化学平衡常数的计算分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )| A、在A点c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在B点c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D、在C点c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
常温下,现有1mL c1 mol/L的醋酸溶液和1mL c2mol/L的氢氧化钠溶液.下列说法中正确的是( )
| A、若c1=c2,则醋酸溶液中的c(H+)与氢氧化钠溶液中的c(OH-)相同 |
| B、若醋酸溶液的pH=3,氢氧化钠溶液的pH=11,则醋酸溶液中的c(CH3COO-)与氢氧化钠钠溶液中的c(Na+)相同 |
| C、将醋酸溶液与氢氧化钠溶液混合,若c1=c2,则所得溶液的pH=7 |
| D、将醋酸溶液与氢氧化钠溶液混合,若所得混合溶液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
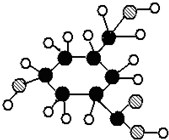
已知A物质的分子结构简式如图 ,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
 ,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )| A、6mol | B、7mol |
| C、9mo1 | D、10mo1 |
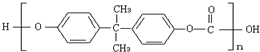 2010年5月1日上海世博会隆重开幕,受到全世界人们的关注.世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,受到全世界人们的关注.世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )| A、它是由碳酸聚合而成的 |
| B、它是通过加聚反应得到的产物 |
| C、它是一种纯净物 |
| D、它不耐强碱,可发生水解反应 |
在下列各组离子中,能在同一溶液中大量共存的是( )
| A、K+、Al3+、SO42-、HCO3- |
| B、K+、H+、NO3-、Fe2+ |
| C、Na+、CO32-、Cl-、Ca2+ |
| D、Na+、Cl-、SO42-、H+ |