题目内容
4.工业上用Fe2(SO4)3酸性溶液处理SO2废气的工艺流程如图,下列说法不正确的是( )
| A. | 溶液的pH:①>②>③ | |
| B. | 整个过程中Fe2(SO4)3溶液可以循环利用 | |
| C. | 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O | |
| D. | 向②溶液中滴加KSCN溶液,溶液可能变为血红色 |
分析 由流程可知,Fe2(SO4)3酸性溶液处理SO2废气,①发生2Fe3++2H2O+SO2=2Fe2++SO42-+4H+,酸性增强,②发生反应4Fe2++O2+4H+=4Fe3++2H2O,硫酸铁可循环使用,KSCN溶液可检验铁离子,以此来解答.
解答 解:A.反应过程中溶液的体积不变,溶液①为Fe2(SO4)3溶液中三价铁离子水解显酸性,溶液②为被二氧化硫还原生成的硫酸亚铁和二氧化硫被氧化生成的硫酸溶液,显酸性,溶液③为硫酸铁溶液和硫酸溶液,是发生反应4Fe2++O2+4H+=4Fe3++2H2O的结果,虽然消耗氢离子但溶液呈酸性,则pH为②>③>①,故A错误;
B.由选项A可知,开始硫酸铁消耗,后来又生成,则硫酸铁可循环使用,故B正确;
C.溶液②转化为溶液③发生反应的离子方程式4Fe2++O2+4H+=4Fe3++2H2O,故C正确;
D.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生2Fe3++2H2O+SO2=2Fe2++SO42-+4H+,②溶液中存在二价铁离子,二价铁离子与KSCN溶液不反应,溶液不会变为血红色,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的氧化还原反应为解答本题的关键,侧重分析与应用能力的考查,注意反应的判断及离子检验,题目难度不大.

练习册系列答案
相关题目
14.用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂.下列说法错误的是( )
| A. | 金属锂作电池的负极 | |
| B. | 电池正极反应为FeS2+4Li++4e-═Fe+2Li2S | |
| C. | 放电时,Li+向负极迁移 | |
| D. | 电池总反应为FeS2+4Li═Fe+2Li2S |
15.下列叙述不正确的是( )
| A. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| B. | 氮元素的非金属性强于磷,氮气活泼性也强于磷 | |
| C. | 农村用明矾净化水,是利用其中Al (OH) 3胶体的吸附性 | |
| D. | NH4F溶液不能存放于玻璃试剂瓶中 |
12.化学与生产、生活密切相关.下列有关说法正确的是( )
| A. | 化学危险品易危害人类,应禁止生产 | |
| B. | 汽车尾气是目前城市大气污染产生的一个重要来源 | |
| C. | 氢氧化钠和氢氧化铝都可用于治疗胃酸过多 | |
| D. | 漂白粉长期放置在空气中不会变质 |
19.下列有关实验装置,能达到实验目的是( )

| A. | 用图1所示装置制取少量Cl2 | B. | 用图2所示装置制取干燥的NH3 | ||
| C. | 用图3制备并检验H2的可燃性 | D. | 用图4装置鉴别碳酸钠和碳酸氢钠 |
6.短周期主族元素Q、W、X、Y、Z原子序数依次增大,Q原子的最外层电子数是其内层电子总数的3倍,W是非金属性最强的元素,X的原子半径在短周期主族元素中为最大,Y是地壳中含量最多的金属元素,Z与Q同主族.下列叙述正确的是( )
| A. | 原子半径;r(Z)>r(W)>r(Q) | |
| B. | 气态氢化物的热稳定性:W>Q>Z | |
| C. | X与Z形成的化合物呈碱性的原因:Z2-+2H2O?H2Z+2OH- | |
| D. | Y与Z的二元化合物可以在溶液中通过复分解反应制得 |
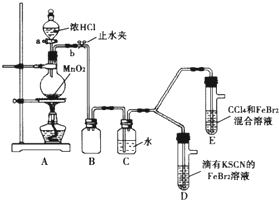 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: