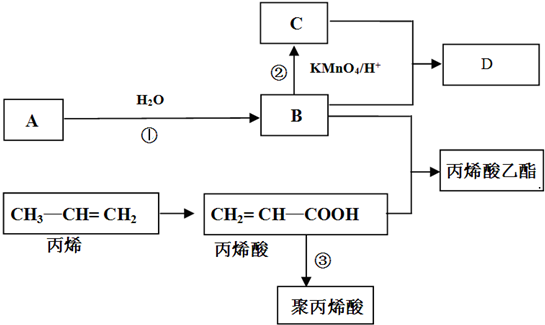
题目内容
17.能大量共存于同一溶液中的离子组是( )| A. | H+,CO32-,Cl-,Na+ | B. | Al3+,NH4+,OH-,NO3- | ||
| C. | Ag+,Br-,SO42-,K+ | D. | NO3-,Na+,H+,Cl- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,以此来解答.
解答 解:A.H+、CO32-结合生成水和气体,不能大量共存,故A不选;
B.Al3+、NH4+均与OH-反应,不能大量共存,故B不选;
C.Ag+分别与Br-、SO42-结合生成沉淀,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
12.在某学生的化学实验报告中有如下记录其中实验数据合理的( )
| A. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| B. | 用托盘天平称取11.7 g CuO粉末 | |
| C. | 用广泛pH试纸测得溶液的pH为3.5 | |
| D. | 温度计上显示的室温读数为25.68 oC |
9.文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨.某兴趣小组对酸雨进行实验研究:
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有SO2(或H2SO3).
(2)设计实验方案验证以上假设.写出实验步骤、预期现象和结论.
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管.
(3)酸雨部分组成测定:(提示:SO2+I2+2H2O=SO42-+2I-+4H+)
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.0200mol/L碘水装入50mL的酸式滴定管中,进行滴定操作.三次操作到达滴定终点时,平均消耗碘水V mL.
②计算:被碘水氧化的物质的物质的量浓度为$\frac{0.02V}{25}$mol/L(只列出算式,不做运算).
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有SO2(或H2SO3).
(2)设计实验方案验证以上假设.写出实验步骤、预期现象和结论.
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用. | / |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤. | / |
| 步骤3:取少量步骤2得到的滤渣,加入盐酸. | |
| 步骤4: | |
| 步骤5: |
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.0200mol/L碘水装入50mL的酸式滴定管中,进行滴定操作.三次操作到达滴定终点时,平均消耗碘水V mL.
②计算:被碘水氧化的物质的物质的量浓度为$\frac{0.02V}{25}$mol/L(只列出算式,不做运算).





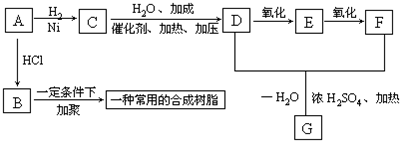
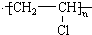 .
.