题目内容
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中溶解度(g/100gH2O)如下:
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有: .
(2)写出上述流程前两步中发生反应的化学方程式为:
,
.
(3)操作Ⅱ洗涤固体的作用是: ,操作Ⅲ的具体过程是: .
(4)流程中NH4HCO3必须过量,其原因是: .

有关物质在水中溶解度(g/100gH2O)如下:
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-40℃NH4F-100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 | 33.3 | 37.2 | 41.4 |
(1)操作Ⅰ需要用到的玻璃仪器有:
(2)写出上述流程前两步中发生反应的化学方程式为:
(3)操作Ⅱ洗涤固体的作用是:
(4)流程中NH4HCO3必须过量,其原因是:
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:第一步反应的方程式,根据已知反应物和生成物,可推知其余生成物,配平即得反应方程式.第二步反应是将第一步生成的NH4F转化为NaF,加入的反应物为NaCl,利用了物质在溶液中溶解度越小则优先析出的特性,所以NaF比NaCl的溶解性小.操作Ⅰ是过滤操作,用到的玻璃仪器包括烧杯、玻璃棒、漏斗;操作Ⅱ是将粗NaF洗涤除去其表面的杂质.操作Ⅲ是将滤液中的溶质进一步提取,故操作是加热蒸发溶剂,析出大量固体后冷却;流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,以防止生成影响制取物质的纯度.
解答:
解:(1)操作Ⅰ是过滤操作,用到的玻璃仪器包括烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(2)第一步反应的方程式,反应物有H2SiF6、和NH4HCO3,生成物有H2SiO3、CO2,根据质量守恒还应有NH4F,则反应的化学方程式为H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O,第二步反应是将第一步生成的NH4F转化为NaF,加入的反应物为NaCl,利用了物质在溶液中溶解度越小则优先析出的特性,所以NaF比NaCl的溶解性小,反应的化学方程式为NH4F+NaCl=NH4Cl+NaF↓,
故答案为:H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O;NH4F+NaCl=NH4Cl+NaF↓;
(3)操作Ⅱ是将粗NaF洗涤除去其表面的杂质,以得到纯净的NaF,操作Ⅲ是将滤液中的溶质进一步提取,故操作是加热蒸发溶剂,析出大量固体后冷却,
故答案为:除去NaF、NH4Cl 表面的杂质;蒸发浓缩溶液,析出多量固体后冷却;
(4))流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,以防止生成Na2SiF6沉淀,影响制取物质的纯度,
故答案为:保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度;
(2)第一步反应的方程式,反应物有H2SiF6、和NH4HCO3,生成物有H2SiO3、CO2,根据质量守恒还应有NH4F,则反应的化学方程式为H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O,第二步反应是将第一步生成的NH4F转化为NaF,加入的反应物为NaCl,利用了物质在溶液中溶解度越小则优先析出的特性,所以NaF比NaCl的溶解性小,反应的化学方程式为NH4F+NaCl=NH4Cl+NaF↓,
故答案为:H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O;NH4F+NaCl=NH4Cl+NaF↓;
(3)操作Ⅱ是将粗NaF洗涤除去其表面的杂质,以得到纯净的NaF,操作Ⅲ是将滤液中的溶质进一步提取,故操作是加热蒸发溶剂,析出大量固体后冷却,
故答案为:除去NaF、NH4Cl 表面的杂质;蒸发浓缩溶液,析出多量固体后冷却;
(4))流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,以防止生成Na2SiF6沉淀,影响制取物质的纯度,
故答案为:保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度;
点评:本题考查较为综合,主要考查了化学与工业生产的相关知识,题目难度中等,注意把握制备流程的反应原理,根据题中信息解答,本题易错点为相关化学方程式的书写,注意从质量守恒的角度思考.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
下列关于化学反应进行的方向说法正确的是( )
| A、放热反应都能自发进行,吸热反应都不能自发进行 |
| B、自发反应的熵一定增大,非自发反应的熵一定减小 |
| C、能自发进行的反应一定能实际发生 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下,22.4 L O2含有的分子数为NA |
| B、常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA |
| C、将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol?L-1 |
| D、标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA |
元素周期表中铋元素的数据见图,下列说法正确的是( )


| A、Bi元素的质量数是209.0 |
| B、Bi元素中子数为83 |
| C、Bi原子6p亚层有有一个未成对电子 |
| D、Bi位于第六周期VA族,属于p区 |
下列物质的分类正确的是( )
| 纯净物 | 碱性氧化物 | 酸性氧化物 | 强电解质 | |
| A | 漂白粉 | SiO2 | CO2 | AlCl3溶液 |
| B | CuSO4?5H2O | Na2O2 | N2O5 | NH4NO3 |
| C | 福尔马林 | CaO | Mn2O7 | HClO |
| D | 冰醋酸 | Na2O | SO2 | HCl |
| A、A | B、B | C、C | D、D |
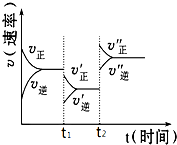 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
只用下列一种试剂,就能鉴别氢氧化钠、氢氧化钙和稀盐酸三种无色溶液的是( )
| A、酚酞试剂 |
| B、氯化钡溶液 |
| C、紫色石蕊试剂 |
| D、碳酸钠溶液 |