题目内容
Co2(OH)2CO3和Co(CH3COO)2?nH2O均是生产高比能锂电池正极材料的前驱体.
(1)这两种钴的化合物中钴的化合价为 .
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,该反应的化学方程式为 .
(3)为确定Co(CH3COO)2?nH2O中的n值及其热分解过程,取一定量的样品在氮气氛围中加热,样品的固体残留率(
×100%)随温度的变化如图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物).
①Co(CH3COO)2?nH2O晶体中 n= (填自然数).
②A→B点反应释放的气体为纯净物(由两种元素组成),该气体的结构简式为 .
③B→C点反应释放CO、CO2两种气体,n(CO):n(CO2)= .
④D点残留固体的化学式为 .(列出上述计算过程)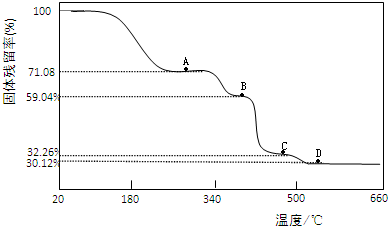
(1)这两种钴的化合物中钴的化合价为
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,该反应的化学方程式为
(3)为确定Co(CH3COO)2?nH2O中的n值及其热分解过程,取一定量的样品在氮气氛围中加热,样品的固体残留率(
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
①Co(CH3COO)2?nH2O晶体中 n=
②A→B点反应释放的气体为纯净物(由两种元素组成),该气体的结构简式为
③B→C点反应释放CO、CO2两种气体,n(CO):n(CO2)=
④D点残留固体的化学式为

考点:探究物质的组成或测量物质的含量
专题:元素及其化合物
分析:(1)根据Co2(OH)2CO3和Co(CH3COO)2?nH2O中已知元素的化合价判断Co的化合价;
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,根据质量守恒定律及化合价变化判断生成物,写出反应的化学方程式;
(3)①Co(CH3COO)2?nH2O在加热过程中首先失去结晶水,所以A点固体为Co(CH3COO)2,根据样品的固体残留率为71.08计算出n值;
②B点剩余的为纯净物,根据题中数据计算出剩余固体的相对分子质量,然后设计成气体的相对分子质量,从而可判断该气体名称、结构简式;
③根据C点样品的固体残留率计算出C点固体组成,然后写出反应的方程式;
④根据D点样品的固体残留率计算出C点固体组成,然后判断其组成,写出固体残留物的化学式.
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,根据质量守恒定律及化合价变化判断生成物,写出反应的化学方程式;
(3)①Co(CH3COO)2?nH2O在加热过程中首先失去结晶水,所以A点固体为Co(CH3COO)2,根据样品的固体残留率为71.08计算出n值;
②B点剩余的为纯净物,根据题中数据计算出剩余固体的相对分子质量,然后设计成气体的相对分子质量,从而可判断该气体名称、结构简式;
③根据C点样品的固体残留率计算出C点固体组成,然后写出反应的方程式;
④根据D点样品的固体残留率计算出C点固体组成,然后判断其组成,写出固体残留物的化学式.
解答:
解:(1)Co2(OH)2CO3中碳酸根离子化合价为-2,氢氧根离子为-1,则Co的化合价为为:
=+2;Co(CH3COO)2?nH2O中醋酸根离子为-1价,则Co的化合价为+2,
故答案为:+2;
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,根据化合价变化,氧气化合价降低,则Co元素化合价升高,根据化合价变化配平可得反应的化学方程式为:3Co2(OH)2CO3+O2
2Co3O4+3CO2+3H2O,
故答案为:3Co2(OH)2CO3+O2
2Co3O4+3CO2+3H2O;
(3)①Co(CH3COO)2?nH2O在加热过程中先失去结晶水,则A点固体为:Co(CH3COO)2,则:
=
,解得:n=4,
故答案为:4;
②根据①可知,原化合物为Co(CH3COO)2?4H2O,相对分子质量为249,
设B点剩余固体的相对分子质量为MrB,则:
=
,解得:MrB=147,A→B固体减少的物质相对分子质量为:177-147=30,因减少的气体是纯净物,则只能为乙烷,B处的剩余固体为CoC2O4,
故答案为:CH3CH3;
③
=
,解得:Mrc=80.33,故C点固体为:Co3O4,反应的化学方程式为:3CoC2O4
Co3O4+4CO↑+2CO2↑,
则n(CO):n(CO2)=2:1,
故答案为:2:1;
④
=
,解得:MrD=75,故D点固体为CoO,
故答案为:CoO.
| 2×1+1×2 |
| 2 |
故答案为:+2;
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,根据化合价变化,氧气化合价降低,则Co元素化合价升高,根据化合价变化配平可得反应的化学方程式为:3Co2(OH)2CO3+O2
| ||
故答案为:3Co2(OH)2CO3+O2
| ||
(3)①Co(CH3COO)2?nH2O在加热过程中先失去结晶水,则A点固体为:Co(CH3COO)2,则:
| 177 |
| 177+18n |
| 71.08 |
| 100 |
故答案为:4;
②根据①可知,原化合物为Co(CH3COO)2?4H2O,相对分子质量为249,
设B点剩余固体的相对分子质量为MrB,则:
| 59.04 |
| 100 |
| MrB |
| 249 |
故答案为:CH3CH3;
③
| 32.26 |
| 100 |
| MrC |
| 249 |
| ||
则n(CO):n(CO2)=2:1,
故答案为:2:1;
④
| 30.12 |
| 100 |
| MrD |
| 249 |
故答案为:CoO.
点评:本题考查了探究物质组成、测量物质含量的方法,题目难度较大,正确理解题干信息及图象曲线变化为解答关键,试题侧重考查学生的分析、理解能力及综合应用所学知识的能力,是一道质量较好的题目.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 |
| B、sp3杂化轨道是由能量相近1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 |
| C、凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 |
| D、氨气分子中有一对未参与杂化的孤对电子 |
下列有关化学实验基本知识和基本操作的描述不正确的是( )
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
下列实验能达到目的是( )
| A、只滴加氨水鉴别AlCl3、MgCl2两种溶液 |
| B、将FeCl3溶液蒸干制备FeCl3固体 |
| C、酒精可将溴水中的溴萃取出来 |
| D、利用是否有丁达尔现象可以区别溶液和胶体 |





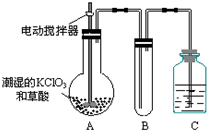 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: