��Ŀ����
����ij������˾�������������������ڽϵ��¶��½�����ת������ϩ��2CH4��g��?C2H4��g��+2H2��g����H����֪�ڽ����¶�ʱ�÷�Ӧƽ�������ƶ�����������������Ӧ��Q1��Q2��Ϊ��ֵ����
��Ӧ��C��s��+2H2��g���TCH4��g����H1=-Q1 ��Ӧ��C��s��+H2��g���T
C2H4��g����H2=-Q2
�������ж���ȷ���ǣ�������
��Ӧ��C��s��+2H2��g���TCH4��g����H1=-Q1 ��Ӧ��C��s��+H2��g���T
| 1 |
| 2 |
�������ж���ȷ���ǣ�������
| A����H��0 |
| B��Q2��Q1 |
| C����H=2��Q1-Q2�� |
| D����H=Q1-Q2 |
���㣺��Ӧ�Ⱥ��ʱ�
ר�⣺��ѧ��Ӧ�е������仯
�������ȸ����¶ȱ仯������ƽ���ƶ��ķ����жϷ�Ӧ2CH4��g��?C2H4��g��+2H2��g���ġ�H������Ȼ�����ø�˹�����жϼ��ɣ�
���
�⣺���¶Ƚ���ʱ����Ӧ2CH4��g��?C2H4��g��+2H2��g��ƽ�����淴Ӧ�����ƶ���˵���÷�Ӧ����Ϊ���ȷ�Ӧ����H��0��
��֪��1��C��s��+2H2��g��?CH4��g������H1=-Q1����
��2��C��s��+H2��g��?
C2H4��g����H2=-Q2����
���ø�˹���ɣ�2��[��2��-��1��]���õ�2CH4��g��?C2H4��g��+2H2��g����H=-2��Q2-Q1��=2��Q1-Q2����
��ѡC��
��֪��1��C��s��+2H2��g��?CH4��g������H1=-Q1����
��2��C��s��+H2��g��?
| 1 |
| 2 |
���ø�˹���ɣ�2��[��2��-��1��]���õ�2CH4��g��?C2H4��g��+2H2��g����H=-2��Q2-Q1��=2��Q1-Q2����
��ѡC��
������������Ҫ�������¶ȶ�ƽ���Ӱ���˹���ɵ����ã��ѶȲ�������ѧ֪ʶ������ɣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
��ͼ�к�����Ϊ���뷴Ӧ������ʵ�����������Ϊ�������������ʵ��������з�Ӧ��Ӧ�����ߴ�����ǣ�������


| A������A����NaAlO2��Һ�е������������� |
| B������B�������ʯ��ˮ��ͨ��CO2������ |
| C������C�����������AlCl3��Һ�е���NaOH��Һ������ |
| D������D�����е����ʵ�����Ca��OH��2��KOH�Ļ����Һ��ͨ��CO2��������ʧ |
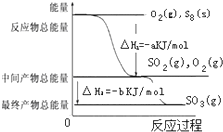 ��һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������Ӧ���̺�������ϵ������ͼ��ʾ��ͼ�еġ�H��ʾ����1 mol�����������ݣ�����ͼ�ó��Ľ�����ȷ���ǣ�������
��һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������Ӧ���̺�������ϵ������ͼ��ʾ��ͼ�еġ�H��ʾ����1 mol�����������ݣ�����ͼ�ó��Ľ�����ȷ���ǣ�������| A��S8��s����ȼ���ȡ�H=-8akJ?mol-1 |
| B��2SO3��g��?2SO2��g��+O2��g������H=-2b kJ?mol-1 |
| C��S8��s��+8O2��g��=8SO2��g������H=-a kJ?mol-1 |
| D����1molS8��s������SO3��g���ķ�Ӧ�ȡ�H=-��a+b��kJ?mol-1 |
��֪H-H����Ϊ436kJ?mol-1��H-N����Ϊ391kJ?mol-1�����ݻ�ѧ����ʽ��N2+3H2?2NH3��H=-92.4kJ?mol-1����N��N���ļ����ǣ�������
| A��431kJ?mol-1 |
| B��946kJ?mol-1? |
| C��649kJ?mol-1 |
| D��869kJ?mol-1? |
һ�������£���Ӧ4NH3��g��+5O2��g��?4NO��g��+6H2O��g����5L�ܱ������н��У�10s��H2O�����ʵ���������0.60mol����10s�ڷ�Ӧ������v��X���ɱ�ʾΪ��������
| A��v ��NH3��=0.008 mol/��L?s�� |
| B��v ��NO��=0.04 mol/��L?s�� |
| C��v ��O2��=0.006 mol/��L?s�� |
| D��v ��H2O��=0.06 mol/��L��min�� |
����������Դ���ǣ�������
| A������ | B����ϫ�� |
| C���Ҵ����� | D���������� |
��֪��101kPa��25�������£�2mol������ȫȼ������ˮ�����ų�484kJ�������������Ȼ�ѧ����ʽ��ȷ���ǣ�������
A��H2O��g��=H2 ��g��+
| ||
| B��2H2 ��g��+O2��g��=2H2O��l����H=-484 kJ�Mmol | ||
C��H2 ��g��+
| ||
| D��2H2 ��g��+O2��g��=2H2O��g����H=+484 kJ�Mmol |
NAΪ�����ӵ����������������������������ٵ��ǣ�������
| A����NA�����ӵĶ������� |
| B��0.5 mol���� |
| C����״����5.6 L���� |
| D��9 gˮ |