题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、23g钠在氧气中完全燃烧失去电子数为0.5NA |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
| C、32g O3和O2的混合气体中共有2NA个氧原子 |
| D、6.8g熔融的KHSO4中含有0.1NA个阳离子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.钠为1价金属,23g钠的物质的量为1mol,完全反应失去1mol电子;
B.标准状况下,己烷为液体,不能使用标况下的气体摩尔体积计算己烷的物质的量;
C.氧气和臭氧分子中注意氧原子,32g氧气和臭氧的混合物中含有32g氧原子,含有2mol氧原子;
D.熔融硫酸氢钾电离出的离子为钠离子和硫酸氢根离子.
B.标准状况下,己烷为液体,不能使用标况下的气体摩尔体积计算己烷的物质的量;
C.氧气和臭氧分子中注意氧原子,32g氧气和臭氧的混合物中含有32g氧原子,含有2mol氧原子;
D.熔融硫酸氢钾电离出的离子为钠离子和硫酸氢根离子.
解答:
解:A.23g钠的物质的量为1mol,1mol钠完全反应失去1mol电子,失去电子数为NA,故A错误;
B.标况下,己烷不是气体,题中条件无法计算22.4L己烷的物质的量,故B错误;
C.32g氧气和臭氧的混合物中含有32g氧原子,32g氧原子的物质的量为2mol,混合气体中共有2NA个氧原子,故C正确;
D.6.8g熔融的KHSO4的物质的量0.05mol,0.05mol熔融硫酸氢钾电离出0.05mol钾离子和0.05mol硫酸氢根离子,含有的阳离子为0.05mol,含有0.05NA个阳离子,故D错误;
故选C.
B.标况下,己烷不是气体,题中条件无法计算22.4L己烷的物质的量,故B错误;
C.32g氧气和臭氧的混合物中含有32g氧原子,32g氧原子的物质的量为2mol,混合气体中共有2NA个氧原子,故C正确;
D.6.8g熔融的KHSO4的物质的量0.05mol,0.05mol熔融硫酸氢钾电离出0.05mol钾离子和0.05mol硫酸氢根离子,含有的阳离子为0.05mol,含有0.05NA个阳离子,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下己烷、水、乙醇等不是气体,选项D为易错点,注意熔融硫酸氢钾中含有的阳离子只有钾离子.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
酸碱质子理论认为,凡能给出质子(H+)的分子或离子都是酸;凡能接受质子的分子或离子都是碱.按此观点,下列粒子既属于酸又属于碱的是( )
①H2O ②ClO- ③Mg2+ ④CO32- ⑤NH4+ ⑥HSO3-.
①H2O ②ClO- ③Mg2+ ④CO32- ⑤NH4+ ⑥HSO3-.
| A、②③ | B、④⑥ | C、①⑥ | D、⑤⑥ |
高温下,某反应达平衡,平衡常数为K=
,恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| A、温度升高时,K值增大 |
| B、恒温恒容下,增大压强,H2浓度可能增大、减小或不变 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为:CO(g)+3H2(g)?CH4 (g)+H2O(g) |
已知X(g)+3Y(g)═2Z(g)△H>0,下列对该反应的说法中正确的是( )
| A、△S>0 |
| B、逆向能自发进行,且反应速率和平衡常数均较大 |
| C、反应物总能量大于生成物总能量 |
| D、在任何温度下都不能自发进行 |
每摩尔物质含有( )
| A、6.02×1023个分子 |
| B、6.02×1023个原子 |
| C、阿伏加德罗常数个原子 |
| D、阿伏加德罗常数个该物质的粒子 |
下列说法中,正确的是( )
A、 -OH与 -OH与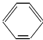 -CH2OH互为同系物 -CH2OH互为同系物 |
| B、乙醇和乙醚互为同分异构体 |
| C、乙醇、乙二醇、丙三醇互为同系物 |
| D、可用浓溴水来区分乙醇苯酚 |
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.