题目内容
A、B、C、D都是短周期主族元素,原子序数依次增大,A原子的最外层电子数是次外层电子数的2倍,B是地壳中含量最高的元素,C是短周期原子半径最大的主族元素,D元素最高正价是+7价.试回答:
(1)这四种元素的名称是:A ,B ,C ,D .
(2)A、B元素的氢化物的稳定性由大而小的顺序是 .
(3)A与B形成三原子分子甲,B与C形成的原子个数比为1:1的化合物乙,写出甲与乙反应的化学方程式 .
(4)用电子式表示A、B两元素形成AB2的过程 .
(1)这四种元素的名称是:A
(2)A、B元素的氢化物的稳定性由大而小的顺序是
(3)A与B形成三原子分子甲,B与C形成的原子个数比为1:1的化合物乙,写出甲与乙反应的化学方程式
(4)用电子式表示A、B两元素形成AB2的过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D都是短周期主族元素,原子序数依次增大,A原子的最外层电子数是次外层电子数的2倍,则A为碳元素,B是地壳中含量最高的元素,则B为氧元素,C是短周期原子半径最大的主族元素,则C为钠元素,D元素最高正价是+7价,原子序数大于钠的短周期元素,所以D为氯元素,据此答题;
解答:
解:A、B、C、D都是短周期主族元素,原子序数依次增大,A原子的最外层电子数是次外层电子数的2倍,则A为碳元素,B是地壳中含量最高的元素,则B为氧元素,C是短周期原子半径最大的主族元素,则C为钠元素,D元素最高正价是+7价,原子序数大于钠的短周期元素,所以D为氯元素,
(1)根据上面的分析可知,这四种元素的名称是:A为碳,B为氧,C为钠,D为氯,
故答案为:碳;氧;钠;氯;
(2)由于氧的非金属性强于碳,所以水的稳定性强于甲烷,
故答案为:H2O>CH4;
(3)A与B形成三原子分子甲为CO2,B与C形成的原子个数比为1:1的化合物乙为Na2O2,它们反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)用电子式表示CO2的形成过程为 ,
,
故答案为: ;
;
(1)根据上面的分析可知,这四种元素的名称是:A为碳,B为氧,C为钠,D为氯,
故答案为:碳;氧;钠;氯;
(2)由于氧的非金属性强于碳,所以水的稳定性强于甲烷,
故答案为:H2O>CH4;
(3)A与B形成三原子分子甲为CO2,B与C形成的原子个数比为1:1的化合物乙为Na2O2,它们反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)用电子式表示CO2的形成过程为
 ,
,故答案为:
 ;
;
点评:本题主要考查了元素周期律、化学方程式、电子式等知识点,难度不大,解题的关键是元素推断.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
关于元素周期表的说法不正确的是( )
| A、元素周期表有7个主族 |
| B、ⅠA族的元素全部是金属元素 |
| C、元素周期表有7个周期 |
| D、短周期是指第一、二、三周期 |
下列离子方程式书写正确的是( )
| A、向氧化镁中加入硫酸溶液 Mg2++SO42-═MgSO4 |
| B、向水中加入钠块 2Na+2H2O═2Na++2OH-+H2↑ |
| C、向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
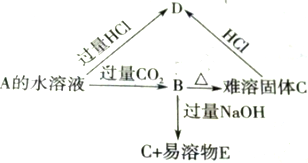 A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低
A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低