题目内容
14.将一定质量的MnO2与足量的浓盐酸完全反应,测得被氧化HCl的质量为7.3g,其反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.请回答:(1)标准状况下生成Cl2的体积是2.24L;
(2)反应中消耗MnO2的质量是8.7g.
分析 根据MnO2+4HCl═MnCl2+Cl2↑+2H2O反应,被氧化HCl是参加反应HCl量的一半,所以得到关系式为:2HCl(被氧化)~~Cl2↑~~MnO2,由此分析解答.
解答 解:设标准状况下生成Cl2的体积是nL,反应中消耗MnO2的质量是mg,
则 2HCl(被氧化)~~Cl2↑~~MnO2,
2×36.5g 22.4L 87g
7.3g nL mg
所以$\frac{2×36.5}{7.3}=\frac{22.4}{n}=\frac{87}{m}$
解之得:n=2.24L;m=8.7g
故答案为:(1)2.24;(2)8.7.
点评 本题考查了氧化还原反应的计算,明确物质间的关系是解本题关键,根据关系式进行解答即可,难度不大.

练习册系列答案
相关题目
4.(1)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为杂质)
(2)亚硫酸钠晶体易氧化变质,简述检验亚硫酸钠晶体是否变质的方法取少量亚硫酸钠晶体加蒸馏水溶解,滴入BaCl2溶液,再滴加足量盐酸,若还有白色沉淀,则晶体已变质.
| 物 质 | 加入试剂的化学式 | 有关离子方程式 |
| NaCl(Na2SO4) | ||
| FeCl2(FeCl3) | ||
| Na2CO3 溶液(NaHCO3) |
5.下列互为同位素的是( )
| A. | H2O和D2O | B. | H2和D2 | C. | ${\;}_{1}^{1}H$和${\;}_{1}^{2}H$ | D. | H2O和H2O2 |
2.下面有关Na2CO3与NaHCO3的叙述错误的是( )
| A. | Na2CO3遇少量酸可转化为NaHCO3 | |
| B. | 在水中的溶解度Na2CO3比NaHCO3大 | |
| C. | NaHCO3能与Ca(OH)2溶液反应,而Na2CO3不能 | |
| D. | 与同浓度的盐酸反应时,NaHCO3比Na2CO3剧烈 |
19. 某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
 某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )| A. | 一定有△H1<0 | B. | 一定有△H2<0 | ||
| C. | 一定有△H1<0,△H2>0 | D. | 一定有△H1+△H2=0 |
3.现取mg镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该说法中不正确的有( )
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
4.下列指定反应的离子方程式正确的是( )
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
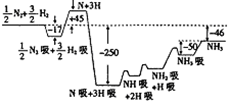 2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题: