题目内容
某原子
X,它的氯化物XCl 7.45g溶于水制成溶液后,加入2mol?L-1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
(1)Z值= 和A= 值;
(2)X元素在周期表中的位置第 周期 族.
A Z |
(1)Z值=
(2)X元素在周期表中的位置第
考点:化学方程式的有关计算,元素周期表的结构及其应用,质量数与质子数、中子数之间的相互关系
专题:计算题
分析:(1)根据n=cV计算硝酸银的物质的量,发生反应XCl+AgNO3=AgCl↓+XNO3,据此计算XCl物质的量,根据M=
计算其摩尔质量,进而计算X的质量数A,再根据质子数=质量数-中子数计算;
(2)根据质子数确定元素在周期表中的位置.
| m |
| n |
(2)根据质子数确定元素在周期表中的位置.
解答:
解:(1)硝酸银的物质的量为2mol/L×0.05L=0.1mol,则:
XCl+AgNO3=AgCl↓+XNO3
0.1mol 0.1mol
故XCl的摩尔质量=
=74.5g/mol,故X的相对原子质量为74.5-35.5=39,故X的质量数A=39,X的质子数=39-10=19,
故答案为:Z=19、A=39;
(2)X的质子数为19,原子核外电子排布为1s22s22p63s23p64s1,故处于第四周期第ⅠA族,
故答案为:四、ⅠA族.
XCl+AgNO3=AgCl↓+XNO3
0.1mol 0.1mol
故XCl的摩尔质量=
| 7.45g |
| 0.1mol |
故答案为:Z=19、A=39;
(2)X的质子数为19,原子核外电子排布为1s22s22p63s23p64s1,故处于第四周期第ⅠA族,
故答案为:四、ⅠA族.
点评:本题考查根据方程式计算、元素推断等,比较基础,根据计算确定元素是关键,侧重对基础知识的巩固.

练习册系列答案
相关题目
下列实验操作正确的是( )
| A、用分液的方法分离汽油和煤油 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、不慎将苯酚溶液沾到皮肤上,立即用稀NaOH溶液清洗 |
| D、用饱和溴水除去苯中的苯酚 |
中小学生普遍使用的修正液中含有铅、苯、钡等对人体有害的化学物质,尤其是苯会引起慢性中毒,从而危害人体健康,如长期使用此类产品,甚至会导致白血病等并发症.对于这一“无形杀手”的评价中,不合理的是( )
| A、修正液中的苯可以发生取代反应 |
| B、苯在修正液中做溶剂 |
| C、应该教育孩子慎用修正液 |
| D、修正液中的苯是一种白色液体 |
下列装置中,电流计G中有电流通过的是( )
A、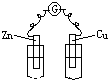 稀H2SO4 |
B、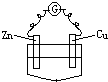 乙醇 |
C、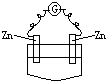 稀H2SO4 |
D、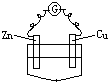 CuSO4溶液 |
如图所示的装置可用于( )


| A、加热小苏打制二氧化碳 |
| B、用铜与稀硝酸反应制一氧化氮 |
| C、用氯化铵与浓氢氧化钠溶液反应制氨气 |
| D、用氯化钠与浓硫酸反应制氯化氢 |

 化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.