题目内容
16.将甲、乙两种有机混合物在常温常压下分离,已知它们的物理性质如下:| 物质 | 密度(g/ml-3) | 沸点(℃) | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
| A. | 分液 | B. | 蒸馏 | C. | 干馏 | D. | 萃取 |
分析 由信息可知,二者互溶,但沸点不同,以此来解答.
解答 解:由信息可知,二者互溶,但沸点不同,则选择蒸馏法分离,
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
11. 以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
 以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )| A. | 电解过程中左侧发生的电极反应式:40H--4e-═2H2O+O2↑ | |
| B. | 电解过程中左侧溶液中的0H-通过离子交换膜向右侧溶液移动 | |
| C. | 电解一段时间后左、右两侧溶液中的K+的物质的量浓度不变 | |
| D. | 电解初期,右侧溶液能变蓝色,继续电解,溶液的蓝色一定加深 |
2.随着氮氧化物污染的日趋严重,国家将于“十三五”期间加大对氮氧化物排放的控制力度.目前,消除氮氧化物污染的方法有多种.
(1)用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是降低N2的浓度.
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(I)△H=-44.0kJ•mol-1
写出CH4 (g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1.
(3)①取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)?N2O4(g)△H<0.反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中如图1,可能与实验结果相符的是BD.
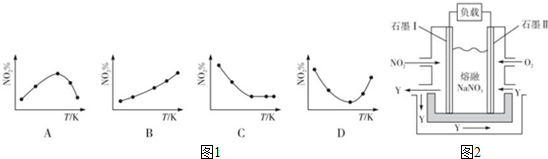
②保持温度、体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率增大(填“增大”、“减小”、“不变”或“无法确定”).
③由NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,其电极反应式NO2+NO3--e-=N2O5.
(1)用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(I)△H=-44.0kJ•mol-1
写出CH4 (g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1.
(3)①取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)?N2O4(g)△H<0.反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中如图1,可能与实验结果相符的是BD.

②保持温度、体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率增大(填“增大”、“减小”、“不变”或“无法确定”).
③由NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,其电极反应式NO2+NO3--e-=N2O5.
6.下列除杂所用的仪器方法,不正确的是( )
| A. | 苯中的甲苯:加溴水分液 | |
| B. | 乙醇中的水:加新制CaO蒸馏 | |
| C. | 甲烷中的乙烯:用溴的四氯化碳溶液洗气 | |
| D. | 乙酸乙酯中的乙酸:加饱和Na2CO3溶液分液 |
7.下列指定反应的离子方程式正确的是( )
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
