题目内容
现有下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H3=-890kJ?mol-1
④CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H4=-1 367kJ?mol-1
(1)下列说法正确的是 .
A.C(s)不完全燃烧的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
B.CH4的燃烧热比CO的燃烧热大
C.△H4>△H3>△H2>△H1
D.CO(g)具有的能量比CO2(g)高
E.1mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367kJ的热量
(2)常温下,取体积比为4:1的甲烷和CO的混合气体112L(标准状况),经完全燃烧后恢复至室温,放出的热量为 kJ.
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H3=-890kJ?mol-1
④CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H4=-1 367kJ?mol-1
(1)下列说法正确的是
A.C(s)不完全燃烧的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
B.CH4的燃烧热比CO的燃烧热大
C.△H4>△H3>△H2>△H1
D.CO(g)具有的能量比CO2(g)高
E.1mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367kJ的热量
(2)常温下,取体积比为4:1的甲烷和CO的混合气体112L(标准状况),经完全燃烧后恢复至室温,放出的热量为
考点:热化学方程式,有关反应热的计算,反应热的大小比较
专题:化学反应中的能量变化
分析:(1)A、根据盖斯定律,将①、②两式适当的变形来求解,由①×2-②得2C(s)+O2(g)═2CO(g),其△H=2△H1-△H2=2×(-393.5kJ?mol-1)-(-566 kJ?mol-1)=-221 kJ?mol-1;
B、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由CH4、CO的燃烧热分别为890 kJ?mol-1、283 kJ?mol-1;
C、比较△H需带“-”号,放热反应的反应热比吸热反应的反应热小;
D、根据已知提供的热方程式无法判断两者能量的高低;
E、物质量相同的同一物质,气态比液态能量高,液态比固态能量高;
(2)用Q=n(可燃物)△H来求解,由4 mol CH4和1 mol CO完全燃烧放出的热量为4×890+566×
=3 843 kJ;
B、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由CH4、CO的燃烧热分别为890 kJ?mol-1、283 kJ?mol-1;
C、比较△H需带“-”号,放热反应的反应热比吸热反应的反应热小;
D、根据已知提供的热方程式无法判断两者能量的高低;
E、物质量相同的同一物质,气态比液态能量高,液态比固态能量高;
(2)用Q=n(可燃物)△H来求解,由4 mol CH4和1 mol CO完全燃烧放出的热量为4×890+566×
| 1 |
| 2 |
解答:
解:(1)A、由①×2-②得2C(s)+O2(g)═2CO(g),其△H=2△H1-△H2=2×(-393.5kJ?mol-1)-(-566 kJ?mol-1)=-221 kJ?mol-1,故A正确;
B、由CH4、CO的燃烧热分别为890 kJ?mol-1、283 kJ?mol-1,故B项正确;
C、比较△H需带“-”号,放热反应的反应热比吸热反应的反应热小,正确的顺序为△H4<△H3<△H2<△H1,故C错误,
D、根据已知提供的热方程式无法判断两者能量的高低,故D错误;
E、物质量相同的同一物质,气态比液态能量高,液态比固态能量高,所以C2H5OH(g)能量高于C2H5OH(l),故E正确.
故答案为:A、B、E;
(2)由4 mol CH4和1 mol CO完全燃烧放出的热量为4×890+566×
=3843 kJ,故答案为:3843.
B、由CH4、CO的燃烧热分别为890 kJ?mol-1、283 kJ?mol-1,故B项正确;
C、比较△H需带“-”号,放热反应的反应热比吸热反应的反应热小,正确的顺序为△H4<△H3<△H2<△H1,故C错误,
D、根据已知提供的热方程式无法判断两者能量的高低,故D错误;
E、物质量相同的同一物质,气态比液态能量高,液态比固态能量高,所以C2H5OH(g)能量高于C2H5OH(l),故E正确.
故答案为:A、B、E;
(2)由4 mol CH4和1 mol CO完全燃烧放出的热量为4×890+566×
| 1 |
| 2 |
点评:本题考查化学反应中的能量变化,明确反应热的表示方法、同一物质状态不同具有的能量不同,要明确比较反应热大小时包括性质符号.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、某二元弱酸的酸式盐NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| B、0.1 mol?L-1 HCN与0.1 mol?L-1 NaCN等体积混合得到的碱性混合溶液中:c(Na+)<c(CN-) |
| C、在物质的量浓度均为0.01 mol?L-1 CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)<0.02 mol?L-1 |
| D、c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c(NH4HCO3)>c(NH4Cl)=2c[(NH4)2SO4] |
常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是( )
| A、混合前的醋酸约1%发生电离 |
| B、混合后的溶液中c(Na+)=c(CH3COO-) |
| C、氢氧化钠和醋酸的浓度不相等 |
| D、混合后的溶液呈中性 |
ClO2是一种消毒杀菌效率高,二次污染小的水处理剂.实验室可通过以下反应制得:2NaClO3+Na2SO3+H2SO4═2ClO2+2Na2SO4+H2O,下列关于该反应的叙述正确的是( )
| A、NaClO3在反应中被氧化 |
| B、1mol NaClO3参加反应有2mol电子转移 |
| C、氧化性ClO2>NaClO3 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
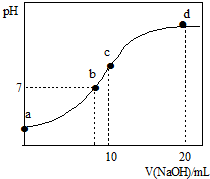 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.

