题目内容
切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如下:

①反应Ⅰ是 反应(填“放热”或“吸热”),判断依据是 .
②1mol Na(s)全部氧化成Na2O(s)的热化学方程式是 .
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 .
(3)白色粉末为Na2CO3.将其溶于水配制为0.1mol/L Na2CO3溶液,下列说法正确的是 (填字母).
a.升高温度,溶液的pH降低
b.c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
c.加入少量NaOH固体,c(CO32-)与c(Na+)均增大
d.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
(4)钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题.
①钠比锂活泼,用原子结构解释原因 .
②ZEBRA电池是一种钠电池,总反应为NiCl2+2Na?Ni+2NaCl.其正极反应式是 .

(1)反应Ⅰ的反应过程与能量变化的关系如下:

①反应Ⅰ是
②1mol Na(s)全部氧化成Na2O(s)的热化学方程式是
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是
(3)白色粉末为Na2CO3.将其溶于水配制为0.1mol/L Na2CO3溶液,下列说法正确的是
a.升高温度,溶液的pH降低
b.c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
c.加入少量NaOH固体,c(CO32-)与c(Na+)均增大
d.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
(4)钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题.
①钠比锂活泼,用原子结构解释原因
②ZEBRA电池是一种钠电池,总反应为NiCl2+2Na?Ni+2NaCl.其正极反应式是
考点:反应热和焓变,化学电源新型电池,盐类水解的应用,钠的重要化合物
专题:化学反应中的能量变化,电化学专题,元素及其化合物
分析:(1)①反应物总能量高于生成物总能量,反应是放热的,反之是吸热的;
②根据热化学方程式的含义和书写方法来回答;
(2)氧化钠和水之间反应生成氢氧化钠,氢氧化钠是既含有离子键又含有共价键的离子化合物,根据电子式的书写方法来书写;
(3)a.水解是吸热的过程;
b.溶液中存在质子守恒c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),即c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3);
c.加入少量NaOH固体,CO32-的水解受到抑制;
d.根据水解原理判断离子浓度大小;
(4)①同一主族元素的原子,原子半径越大,金属活泼性越强;
②原电池的正极上发生得电子的还原反应.
②根据热化学方程式的含义和书写方法来回答;
(2)氧化钠和水之间反应生成氢氧化钠,氢氧化钠是既含有离子键又含有共价键的离子化合物,根据电子式的书写方法来书写;
(3)a.水解是吸热的过程;
b.溶液中存在质子守恒c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),即c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3);
c.加入少量NaOH固体,CO32-的水解受到抑制;
d.根据水解原理判断离子浓度大小;
(4)①同一主族元素的原子,原子半径越大,金属活泼性越强;
②原电池的正极上发生得电子的还原反应.
解答:
解:(1)①根据图中所示的信息知道:反应物总能量高于生成物总能量,所以反应是放热的,故答案为:放热;反应物总能量高于生成物总能量;
②根据图中所示的信息可以书写热化学方程式为:Na(s)+
O2(g)=
Na2O(s)△H=-207 kJ/mol,故答案为:Na(s)+
O2(g)=
Na2O(s)△H=-207 kJ/mol;
(2)氧化钠和水之间反应生成氢氧化钠,氢氧化钠是既含有离子键又含有共价键的离子化合物,电子式为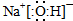 ,故答案为:
,故答案为: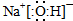 ;
;
(3)a.碳酸钠中碳酸根离子水解是吸热的过程,所以升高温度,溶液的pH增大,故a错误;
b.溶液中存在质子守恒:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),即;
c.加入少量NaOH固体,CO32-的水解受到抑制,所以c(CO32-)与c(Na+)均增大,故c正确;
d.离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故d错误.
故选bc;
(4)①同一主族元素的原子Na、Li,原子半径越大,金属活泼性越强,即钠比锂活泼,故答案为:最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强;
②ZEBRA电池的正极上发生得电子的还原反应,即NiCl2+2Na++2e-=Ni+2NaCl,故答案为:NiCl2+2Na++2e-=Ni+2NaCl.
②根据图中所示的信息可以书写热化学方程式为:Na(s)+
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
(2)氧化钠和水之间反应生成氢氧化钠,氢氧化钠是既含有离子键又含有共价键的离子化合物,电子式为
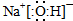 ,故答案为:
,故答案为: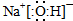 ;
;(3)a.碳酸钠中碳酸根离子水解是吸热的过程,所以升高温度,溶液的pH增大,故a错误;
b.溶液中存在质子守恒:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),即;
c.加入少量NaOH固体,CO32-的水解受到抑制,所以c(CO32-)与c(Na+)均增大,故c正确;
d.离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故d错误.
故选bc;
(4)①同一主族元素的原子Na、Li,原子半径越大,金属活泼性越强,即钠比锂活泼,故答案为:最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强;
②ZEBRA电池的正极上发生得电子的还原反应,即NiCl2+2Na++2e-=Ni+2NaCl,故答案为:NiCl2+2Na++2e-=Ni+2NaCl.
点评:本题涉及热化学、电化学、盐的水解原理的应用以及影响平衡移动的因素等方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)和Ksp(AgCl)均保持不变的是( )
| A、加热 |
| B、加少量水稀释 |
| C、加入少量盐酸 |
| D、加入少量AgNO3 |
 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A、M是芳香族化合物,它的分子式为C9H6O4 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、1mol M最多能与含有3mol NaOH的溶液发生反应 |
| D、在一定条件下能发生取代、加成、水解、氧化等反应 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、46g乙醇中含有的化学键数为7NA |
| B、1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C、1mol OH-和1mol-OH(羟基)中含有的质子数均为9NA |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题: