题目内容
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 50mL12mol/L的盐酸与足量MnO2共热,转移电子数为0.3NA | |
| D. | 2.0gH218O与D216O的混合物中所含中子数为NA |
分析 A.氢氧化钠溶液中,氢氧根离子抑制了水的电离,则水电离的氢氧根离子浓度=氢离子浓度;
B.质量数=质子数+中子数;
C.二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
D.物质的量n=$\frac{m}{M}$,质量数=质子数+中子数计算分析.
解答 解:A.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-13mol/L,故A错误;
B.原子中含中子数=0.1mol(90-38)×NA=5.2NA,故B错误;
C.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,故转移的电子数小于0.3NA个,故C错误;
D.2.0gH218O物质的量n=$\frac{2.0g}{20g/mol}$=0.1mol,中子数=0.1mol(0+18-8)×NA=NA,D216O的物质的量=$\frac{2.0g}{20g/mol}$=0.1mol,2.0gH218O与D216O的混合物中所含中子数为NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意二氧化锰和浓盐酸反应,随浓度减小不能生成氯气,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关实验说法正确的是( )
| A. | 金属钠长期露置在空气中,最终生成碳酸钠,中间有Na2O2生成 | |
| B. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度盐酸反应速率快慢时,可以加几滴KSCN溶液,观察铁钉周围出现出现血红色现象的快慢 | |
| C. | 原电池的制作:用导线把二极管和锌片、铜片连接起来,锌与铜之间隔一块薄海绵放入稀H2SO4 溶液,二极管发光但很快变暗,若再加入H2O2瞬间又变亮且能持续较长时间 | |
| D. | 在蔗糖中滴加浓硫酸产生的气体,能使酸性KMnO4溶液褪色,说明该气体具有漂白性 |
15.实验室模拟“人工树叶”将H2O和CO2转化为O2和C6Hl2O6,以下说法正确的是( )
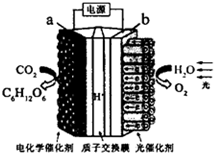

| A. | a极与电源的正极相连 | |
| B. | 该装置能量转化形式仅为电能转化为化学能 | |
| C. | 阳极反应为 6COz+24H+-24e-=C6Hl206+6H20 | |
| D. | 电解后阳极区溶液的pH不变(忽略体积影响) |
12.下列有关实验操作、现象或结论的叙述正确的是( )
| A. | 石油的蒸馏实验中,加入碎瓷片可防止石油在蒸馏时暴沸 | |
| B. | 乙醇的催化氧化实验中铜丝主要起氧化剂的作用 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入乙酸,最后加入浓硫酸 | |
| D. | 在淀粉溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明淀粉没有水解 | |
| E. | 除去甲烷中混有的少量乙烯,可以将混合气体通过酸性溶KMnO4液 | |
| F. | 用钠可以检验某无水酒精中是否含有水 | |
| G. | 可用溴水来鉴别植物油和矿物油 |
9.下列表述正确的是( )
| A. | 16O2与18O2互为同素异形体 | |
| B. | Na2S的电子式为: | |
| C. | 熔融状态下硫酸氢钾的电离方程式:KHSO4=K++H++SO42- | |
| D. | 钢铁表面常常出现的铁锈的主要成分是Fe2O3•xH2O,它不能阻止钢铁继续腐蚀 |
16.当干冰气化时,下列所述各项中发生变化的是( )
| A. | 分子间距离 | B. | 范德华力 | C. | 分子内共价键 | D. | 化学性质 |
19.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
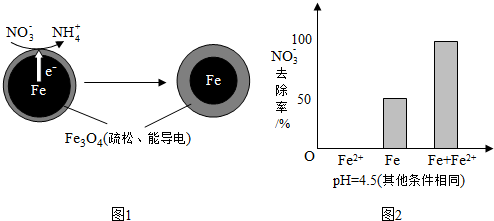
(1)Fe还原水体中NO3-的反应原理如图1所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低.其原因是FeO(OH)不导电,阻碍电子转移.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如表:
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.

(1)Fe还原水体中NO3-的反应原理如图1所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 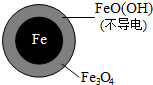 |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |

 (R、R′为烃基)
(R、R′为烃基)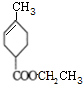 ,D的化学式为C8H11O2Na.
,D的化学式为C8H11O2Na.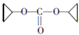 .
. .
. .
.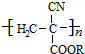 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下: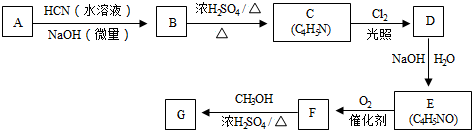
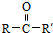 $→_{NaOH(微量)}^{HCN(水溶液)}$
$→_{NaOH(微量)}^{HCN(水溶液)}$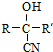
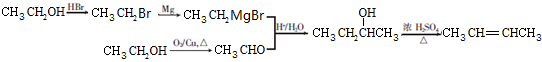
 .其核磁共振氢谱显示为2组峰,峰面积比为1:6.
.其核磁共振氢谱显示为2组峰,峰面积比为1:6. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.