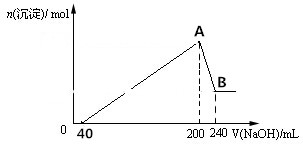
题目内容
10.氢氟酸是一种弱酸,已知25℃时:①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
在20mL 0.1mol/L氢氟酸中加V mL 0.1mol/L NaOH溶液.下列说法错误的是( )
| A. | 氢氟酸电离的热化学方程式为:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1 | |
| B. | 当V=20时,溶液中:c(OH-)=c(H+)+c(HF) | |
| C. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol/L | |
| D. | 当V=20时,溶液中水的电离程度最大(忽略溶液温度的变化) |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,可根据质子守恒判断;
C.当V=20时,恰好反应生成NaF,溶液呈碱性,结合电荷守恒判断;
D.V=20mL恰好反应生成NaF,F-水解促进了水的电离.
解答 解:A.利用盖斯定律将①-②可得:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A正确;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据质子守恒可得:c(OH-)=c(HF)+c(H+),故B正确;
C.当V=20时,恰好反应生成NaF,应F-水解,则c(F-)<c(Na+)=0.05mol•L-1,故C错误;
D.当V=20mL恰好反应生成NaF,F-水解促进了水的电离,溶液中水的电离程度最大,故D正确;
故选C.
点评 本题考查酸碱混合的定性判断及计算,题目难度中等,明确盖斯定律的含义及应用方法为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据质子守恒判断离子浓度大小.

练习册系列答案
相关题目
20.用Na2SO3溶液吸收硫酸工业尾气中的SO2,Na2SO3+5O2+H2O═2NaHSO3所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如图.下列说法不正确的是( )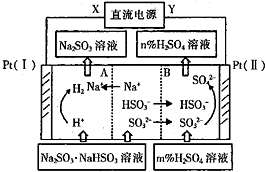

| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
18.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4 (难溶盐)、Pb(MnO4)2(高锰酸铅强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中应失去3.01×1023个电子.下列说法中不正确的是( )
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液:K+、Na+、CH3COO-、ClO- | |
| B. | 0.1mol•L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LFeCl3溶液中:Al3+、NH4+、SCN-、SO42- | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、SO42- |
15.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
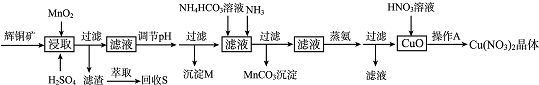
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.