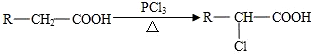
题目内容
1.铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2•12H2O]的工艺流程如图所示;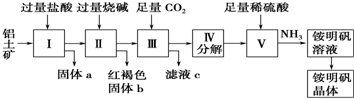
请回答下列问题:
(1)固体a的化学式为SiO2,Ⅲ中通入足量CO2气体发生反应的离子方程式为AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓.
(2)由Ⅴ制取铵明矾溶液的化学方程式为Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O,
从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)蒸发浓缩、冷却结晶、过滤洗涤.
(3)以1 000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84g•cm-1)575.4L(保留4位有效数字).
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为3:10.
分析 铝土矿用盐酸溶解,Al2O3、Fe2O3与盐酸反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色固体b为氢氧化铁,溶液Ⅲ中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,碳酸的酸性强于偏铝酸,故二氧化碳与偏铝酸钠生成氢氧化铝沉淀;
(2)Al2O3与稀硫酸、氨气反应生成铵明矾溶液;依据从可溶性溶液中获取固体的实验方法回答;
(3)依据化学反应方程式以及给出的数据计算即可;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可.
解答 解:铝土矿用盐酸溶解,Al2O3、Fe2O3与盐酸反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色固体b为氢氧化铁,溶液Ⅲ中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2,Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀,
故答案为:SiO2; AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓;
(2)Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;蒸发浓缩;
(3)m(Al2O3)=1 000 kg×36%=360 kg,
依据:Al2O3+3H2SO4=Al2(SO4)3+3H2O
102 294
360kg m(H2SO4)
故m(H2SO4)=$\frac{294×360}{102}$=1037.6 kg,需消耗质量分数98%的硫酸(密度1.84 g•cm-3)为=$\frac{1037.6÷98%}{1.84}$=575.4 L,
故答案为:575.4;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2•12H2O的物质的量都是1 mol,则Al3+共3 mol,SO42-共5 mol,根据Al3+和SO42-守恒原理可得,加入Al2O3和H2SO4的物质的量之比为:$\frac{3}{2}$:5=3:10,
故答案为:3:10.
点评 本题考查物质的分离和提纯的方法和基本操作综合应用,为高频考点,侧重于学生的分析能力的考查,题目注重氧化物与酸或碱的反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

 名校课堂系列答案
名校课堂系列答案(I)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、1mol/L KOH溶液、淀粉溶液)
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| c(KI) | V | c(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | 1组和2组探究②0.2mol/L温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/LKOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
| A. | 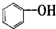 属于醇类化合物 属于醇类化合物 | B. | 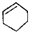 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 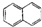 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
| A. | 辛烯和3-甲基-1-丁烯 | B. | 甲苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基环己烷和己烯 |
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)
 .
.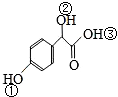 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.