题目内容
2.已知X、Y、Z、Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为C,X、Y、Z中第一电离能最大的是N.
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
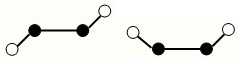
该分子中Y原子的杂化方式是sp2.
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示
 ,有关该晶体的说法正确的是
,有关该晶体的说法正确的是BCD(填写字母序号).
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为CO.
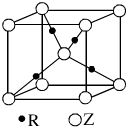
(5)R的基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)),R与Z形成的某离子晶体的晶胞结构如下图,则该晶体的化学式为Cu2O,该晶体的密度为a g•cm-3,则晶胞的体积是$\frac{288}{aNA}$cm3(用含a、NA的代数式表示).
分析 X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,核外电子排布为1s22s22p2,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,离子核外电子排布为1s22s22p63s23p63d10,则R为Cu元素,据此进行解答.
解答 解:X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,核外电子排布为1s22s22p2,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,离子核外电子排布为1s22s22p63s23p63d10,则R为Cu元素,
(1)由上述分析可知,R为Cu元素,同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,
故答案为:Cu;N;
(2)Y2Q2为N2F2,有如图2种结构,N原子之间形成N═N双键,N与F原子之间形成N-F单键,杂化轨道数=σ键数+孤对电子对数,该分子中N原子的杂化轨道数=2+1=3,所以N原子杂化方式是sp2杂化,
故答案为:sp2;
(3)A.X与Y元素可以形成一种超硬新材料,不可能是分子晶体,由晶体部分结构可知,该晶体为原子晶体,故A错误;
B.C-N键键长比C-C键长短,C-N键键能大,所以晶体的硬度比金刚石还大,故B正确;
C.结构中每个X原子周围有4个Y原子,每个Y原子周围有3个X原子,所以该晶体化学式为X3Y4,即为C3N4,故C正确;
D.该晶体为原子晶体,晶体熔化时共价键被破坏,没有克服范德华力和氢键,故D正确;
故答案为:BCD;
(4)有一种AB型分子与N2分子互为等电子体,它是一种常用的还原剂,其化学式为CO,
故答案为:CO;
(5)R为Cu元素,核外有29个电子,其基态原子的电子排布式为:1s22s22p63s23p63d104s1,
晶胞中Cu原子数目=4、O原子数目=1+8×$\frac{1}{8}$=2,故该晶体的化学式为Cu2O,晶胞质量=2×$\frac{144}{{N}_{A}}$g,该晶体的密度为ag•cm-3,则晶胞的体积=$\frac{2×\frac{144}{{N}_{A}g}}{ag•c{m}^{-3}}$=$\frac{288}{a•{N}_{A}}$cm3,
故答案为:1s22s22p63s23p63d104s1;Cu2O;$\frac{288}{a•{N}_{A}}$.
点评 本题考查物质结构与性质,题目难度中等,涉及元素推断、核外电子排布、电离能、化学键、晶体结构与性质、晶胞计算等,考查学生对信息的理解和知识综合应用的能力,注意利用均摊法进行晶胞计算.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案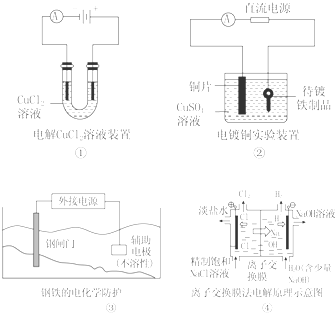
| A. | ①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
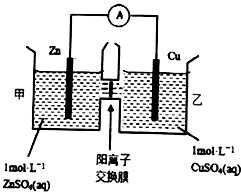
| A. | 铜电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电池工作一段时间后,乙池溶液的总质量不变 | |
| D. | 阳离子通过交换膜向正极移动,保持溶液中电荷平衡 |
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:下列判断正确的是( )
| A. | 三个容器中的反应速率相同 | |
| B. | 丙中的平衡常数最大,甲中最小 | |
| C. | 当容器甲中SO2的转化率为80%时,该反应的平衡常数为160 | |
| D. | 达到平衡时,容器丙中的c(SO3)是容器甲中的两倍 |
 互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )| A. | 9 种 | B. | 8 种 | C. | 7 种 | D. | 10 种 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(酸性KMnO4溶液) | ||
| C. | 硝基苯中的NO2(NaOH溶液) | D. | 苯中的己烯(Br2水) |
