题目内容
2.下列物质属于电解质并能导电的是( )①熔融的NaCl ②KNO3溶液 ③Cu ④酒精 ⑤KCl晶体 ⑥液态氯化氢.
| A. | ① | B. | ①⑥ | C. | ①②⑤ | D. | ①②③⑤ |
分析 电解质是在水溶液中或熔融状态下能导电的化合物;物质导电的原因:要么有自由移动的电子,要么有自由移动的离子.根据要求分析.
解答 解:①熔融的NaCl中有自由移动的离子,能导电,故为电解质;
②KNO3溶液有自由移动的离子,能导电,但是混合物,故不是电解质;
③Cu能导电,但是单质,故不是电解质;
④酒精无自由移动的离子或电子,不能导电;且在水溶液中和熔融状态下均不能导电,故为非电解质;
⑤KCl晶体无自由移动的离子或电子,不能导电;
⑥液态氯化氢无自由移动的离子或电子,不能导电;
满足条件的为,
故选A.
点评 本题考查了电解质与非电解质的概念,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确无论电解质还是非电解质,都一定为化合物,牢记物质导电的条件.

练习册系列答案
相关题目
14.下列化学用语表述正确的是( )
| A. | 甲烷的球棍模型: | B. | 氯化氢的电子式: | ||
| C. | Cl2的结构式:Cl=Cl | D. | 硫离子的结构示意图: |
15.鸡舍中常不断地产生氨气.在大规模养鸡场中,氨气常引发鸡群出现呼吸道疾病,甚至会造成鸡的大批死亡.下列物质不适合于吸收氨气的是( )
| A. | 硫酸溶液 | B. | 醋酸溶液 | C. | Na0H固体 | D. | 硝酸溶液 |
10.在无色透明的溶液中能大量共存的一组离子是( )
| A. | H+、Fe3+、SO42-、Br- | B. | Ba2+、Na+、OH-、MnO4- | ||
| C. | H+、Na+、NO3-、Cl- | D. | Al3+、K+、HCO3-、OH- |
17.设NA为阿伏加德罗常数的值,对反应:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-a kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-b kJ/mol
(a、b均为正值),其他数据如表所示:
下列说法正确的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-a kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-b kJ/mol
(a、b均为正值),其他数据如表所示:
| 化学键 | C=O | O=O | C-H | O-H |
| 键能/kJ•mol-1 | 798 | x | 413 | 463 |
| A. | H2O(g)═H2O(l)△S<0,△H=(a-b)kJ/mol | |
| B. | 当有4NA个C-H键断裂时,该反应放出热量一定为a kJ | |
| C. | x=$\frac{1796-b}{2}$ | |
| D. | 利用反应①设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极一定减轻6.4g |
7.某无色溶液中大量存在以下五种离子:NO3-、SO42-、Al3+、H+、M.其物质的量之比为n(NO3-):n(SO42-):n(Al3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )
| A. | Cu2+ | B. | Mg2+ | C. | CO32- | D. | Na+ |
14. 有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )
有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )
 有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )
有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )| A. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| B. | 该晶体属于离子晶体,M呈+1价 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为12个 |

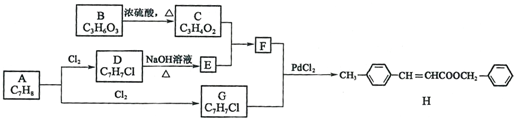
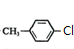 .
. .
.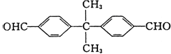 、
、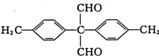 .
.