题目内容
3.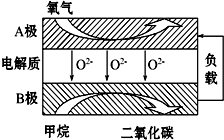 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.回答下列问题:①A极为电池正极,
电极反应式为O2+4e-=2O2-.
②若用该燃料电池作电源,用石墨作电极电解100mL1mol•L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标准状况下).
分析 ①由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,A极是正极,该电极上是氧气得电子的还原反应;
②开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:①由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为CH4+4O2--8e-=CO2+2H2O,A极是正极,该电极上是氧气得电子的还原反应,电极方程式为O2+4e-=2O2-,故答案为:正;O2+4e-=2O2-;
②硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L.
点评 本题综合考查电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,解答本题要注意把握原电池的工作原理,把握电极方程式的书写,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 煤炭燃烧前经过脱硫处理可减少酸雨的产生 | |
| C. | 燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能 | |
| D. | 太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用 |
| A. | 3m+n | B. | 3m+$\frac{n}{2}$ | C. | 3m+3p+$\frac{n}{2}$ | D. | 3m+$\frac{n}{2}$-3p |
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Mg2+ | |
| D. | 某溶液加NaOH溶液生成红褐色沉淀,说明原溶液中有Fe3+ |
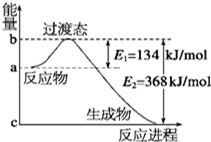 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.