题目内容
某氧化铁样品中含有少量的杂质FeSO4.某实验小组同学要测定其中铁元素的质量分数,他们设计了如下方案进行测定,操作流程为: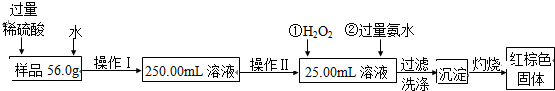
请根据流程回答:
(1)加入过量的稀硫酸,发生反应的离子方程式 ;
(2)操作II中量取25.00mL液体需要使用的仪器是 ;
(3)反应①中,加入足量H2O2溶液的目的是 ;
(4)如何检验加入过氧化氢后,溶液中只有Fe3+而没有Fe2+, ;
(5)检验沉淀是否冼涤干净的操作 .

请根据流程回答:
(1)加入过量的稀硫酸,发生反应的离子方程式
(2)操作II中量取25.00mL液体需要使用的仪器是
(3)反应①中,加入足量H2O2溶液的目的是
(4)如何检验加入过氧化氢后,溶液中只有Fe3+而没有Fe2+,
(5)检验沉淀是否冼涤干净的操作
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁;
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,量取25.00mL酸性溶液应该选择25mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,用可溶性钡盐溶液检验SO42-是否洗涤干净.
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,量取25.00mL酸性溶液应该选择25mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,用可溶性钡盐溶液检验SO42-是否洗涤干净.
解答:
解:氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁,
(1)氧化铁与稀硫酸反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取25.00mL酸性溶液应该选择25mL酸式滴定管,故答案为:25.00mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,故答案为:将Fe2+全部氧化为Fe3+;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
故答案为:取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42-+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42-是否洗涤干净,步骤为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净;
故答案为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净.
(1)氧化铁与稀硫酸反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取25.00mL酸性溶液应该选择25mL酸式滴定管,故答案为:25.00mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,故答案为:将Fe2+全部氧化为Fe3+;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
故答案为:取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42-+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42-是否洗涤干净,步骤为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净;
故答案为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净.
点评:本题考查了物质组成的分析判断,实验探究方法和实验过程分析,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验原理,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
俄、美科学家同时宣称合成了元素周期表上的第113号和第115号元素,第115号元素的
X原子在生成数秒后会衰变成
Y.下列有关叙述中,正确的是( )
289 115 |
285 113 |
| A、115号元素变成113号元素是化学变化 | ||||
B、
| ||||
C、
| ||||
| D、113号元素位于周期表第8周期 |
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
下列四组物质中,两种分子中不具有相同核外电子总数的是:
| A、H2O2和CH3OH |
| B、H2O和CH4 |
| C、NHO2和HClO |
| D、H2S和F2 |
 在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.
在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.

