题目内容
4.为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C三种试剂,按图中的实验步骤进行操作:
(1)试剂的化学式:ABa(OH)2,BK2CO3,CHCl.
(2)加过量A的原因是为了除尽Mg2+、SO42-,有关反应的离子方程式为Mg2++2OH-═Mg(OH)2↓、Mg2++SO42-+Ba2++2OH-═BaSO4↓+Mg(OH)2↓.
(3)加过量B的原因是为了除尽过量的Ba2+,有关反应的化学方程式为Ba(OH)2+K2CO3═2KOH+BaCO3↓、BaCl2+K2CO3═BaCO3↓+2KCl.
(4)加适量C的作用是将KOH转化为KCl,同时除去过量的K2CO3.
分析 除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2以及原有的MgCl2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,以此解答该题.
解答 解:除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2以及原有的MgCl2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,
(1)由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,故答案为:Ba(OH)2;K2CO3;HCl;
(2)加入Ba(OH)2,可生成氢氧化镁和硫酸钡沉淀,可除去Mg2+、SO42-,反应的化学方程式为MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,离子反应分别为Mg2++2OH-═Mg(OH)2↓、Mg2++SO42-+Ba2++2OH-═BaSO4↓+Mg(OH)2↓,
故答案为:为了除尽Mg2+、SO42-;Mg2++2OH-═Mg(OH)2↓、Mg2++SO42-+Ba2++2OH-═BaSO4↓+Mg(OH)2↓;
(3)加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2以及生成的BaCl2完全反应而除去,相关反应的化学方程式有Ba(OH)2+K2CO3═2KOH+BaCO3↓,BaCl2+K2CO3═BaCO3↓+2KCl,
故答案为:为了除尽过量的Ba2+;Ba(OH)2+K2CO3═2KOH+BaCO3↓、BaCl2+K2CO3═BaCO3↓+2KCl;
(4)加适量C的作用是将KOH转化为KCl,同时除去过量的K2CO3,故答案为:将KOH转化为KCl,同时除去过量的K2CO3.
点评 本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法为解答该题的关键,题目难度不大.

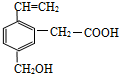 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
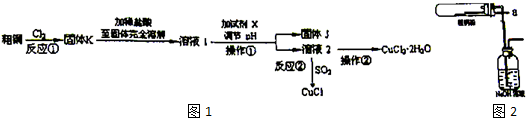
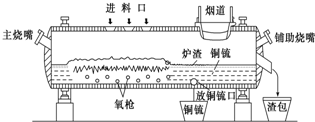
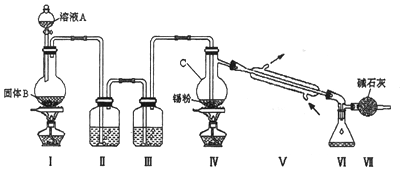
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.