题目内容
某溶液中含有CH3COO-、I-、SO32-、HCO3-、NH4+等五种离子.将少量的CaO固体加入其中后,仍能大量存在的离子是( )
| A、CH3COO-、I-、SO32- |
| B、I-、NH4+、HCO3- |
| C、CH3COO-、I- |
| D、CH3COO-、HCO3- |
考点:离子共存问题
专题:
分析:将少量的CaO固体加入其中,与水反应生成碱,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答:
解:将少量的CaO固体加入其中,与水反应生成碱,碱性溶液中不能大量存在HCO3-、NH4+,且钙离子与SO32-结合生成沉淀,则仍能大量存在的离子是CH3COO-、I-,
故选C.
故选C.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验中,操作正确且能达到相应实验目的是( )
| A、做中和热测定实验时,若没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 |
| B、中和滴定实验中,左手调控滴定管的活塞,右手持锥形瓶,眼睛注视滴定管中液面的变化 |
| C、溴蒸汽和二氧化氮两种红棕色气体可用淀粉碘化钾溶液来鉴别 |
| D、除去蛋白质溶液中少量的NaCl,可将装有混合液的半透膜袋浸入流动的蒸馏水中 |
下列离子方程式书写正确的是( )
| A、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O═Ag(NH3)2++Cl-+2H2O |
| B、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O |
| C、氨气通入醋酸溶液中:NH3+H+=NH4+ |
| D、向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
要提纯下列物质(括号内物质为杂质),实验操作最合理的是( )
| A、CO2(SO2):通入盛有品红溶液的冼气瓶后收集 |
| B、Fe2+(Fe3+):加KSCN溶液后过滤 |
| C、Cl2(HCl):通过盛有饱和氯化钠水溶液的洗气瓶后收集 |
| D、氯化铵溶液(FeCl3):加足量NaOH溶液后过滤 |
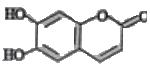 中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )| A、M既能与H2发生加成反应又能使酸性KMnO4溶液褪色 |
| B、1 mol M最多能与2mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、M既能与FeCl3溶液发生显色反应又能与NaHCO3反应放出CO2 |
稀氨水中存在着下列平衡:NH3?H2O═NH4++OH-,若要使平衡向左移动,同时使c(OH-)增大,应加入适量的物质是( )
| A、NH4Cl |
| B、H2SO4 |
| C、NaOH |
| D、H2O |