题目内容
11. 如图为含有少量Zn杂质的粗银电解精炼银的示意图
如图为含有少量Zn杂质的粗银电解精炼银的示意图(1)a(填a或b)极为含有杂质的粗银.
(2)电解一段时间后电解液中c(Ag+)浓度偏小(填偏大,偏小或不变)
(3)若b极有少量红棕色气体生成,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O或NO3-+3e-+4H+=NO↑+2H2O.
分析 (1)电解精炼银时,粗银作阳极,与电源的正极相连;
(2)阳极粗银中活泼的锌优先放电,而阴极银离子在放电;
(3)若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮.
解答 解:(1)电解精炼时,粗银做阳极,所以粗银是a极,故答案为:a;
(2)阳极粗银中活泼的锌优先放电,而阴极银离子在放电,在得失电子守恒的条件下,银离子的物质的量偏小,故答案为:偏小;
(3)b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,
故答案为:NO3-+e-+2H+=NO2↑+H2O或NO3-+3e-+4H+=NO↑+2H2O.
点评 本题考查了电解原理等知识点,根据金属的活泼性确定冶炼方法、离子的放电顺序来分析解答,难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
19.滴加新制氯水后,下列各组离子可能大量存在的是( )
| A. | Fe3+、Al3+、Cl-、NO${\;}_{3}^{-}$ | B. | K+、Na+、I-、SO${\;}_{4}^{2-}$ | ||
| C. | Ag+、Ca2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$ | D. | Na+、Ba2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$ |
6.甲醇、空气和强碱溶液做电解质的手机燃料电池中所发生的反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,下列有关说法正确的是( )
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol | |
| C. | 放电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
16.下列说法正确的是( )
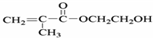
| A. | 1mol化合物 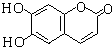 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等 | |
| B. | 等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少 | |
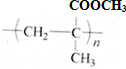
| C. | 聚乳酸(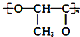 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实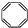 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 |
20.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
 .
. .
.
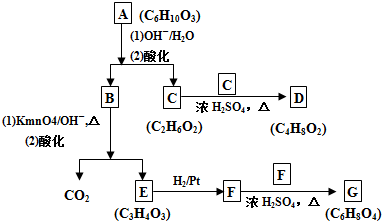
 C:CH2OHCH2OH
C:CH2OHCH2OH E:
E: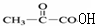
 .
.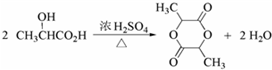 .
.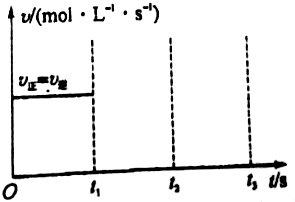 工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.