题目内容
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0KJ?mol-1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5KJ?mol-1;则△H= kJ?mol-1.
(2)高炉炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为 .
②下列说法正确的是 (填字母).
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率.
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0KJ?mol-1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5KJ?mol-1;则△H=
(2)高炉炼铁反应的平衡常数表达式K=
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率.
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据热化学方程式 和盖斯定律计算分析判断;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1依据平衡常数概念写出表达式,反应是吸热反应,升温平衡逆向进行;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,速率甲小于乙;
C.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率.
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1依据平衡常数概念写出表达式,反应是吸热反应,升温平衡逆向进行;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,速率甲小于乙;
C.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率.
解答:
解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,平衡常数K=
;反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:
;减小;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
=
=64,计算得到x=0.6
转化率=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故A正确;
B.乙容器中一氧化碳增加,将乙中CO用K=64,代入三段式计算求得CO减少了1.7mol,故CO的转化率为
=70%,反应速率乙大,故B正确;
C.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:AB.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,平衡常数K=
| c3(CO2) |
| c3(CO) |
故答案为:
| c3(CO2) |
| c3(CO) |
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
| c3(CO2) |
| c3(CO) |
| (1+x)3 |
| (1-x)3 |
转化率=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故A正确;
B.乙容器中一氧化碳增加,将乙中CO用K=64,代入三段式计算求得CO减少了1.7mol,故CO的转化率为
| 1.7 |
| 2.0 |
C.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:AB.
点评:本题考查了热化学方程式和盖斯定律计算应用,平衡常数计算应用,化学平衡三段式列式计算方法,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
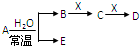 已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)
已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)下列说法正确的是( )
| A、若E为氧化物,则X一定为Fe |
| B、若E为氧化物,则在A与水的反应中,氧化剂和还原剂的质量比为1:2 |
| C、若E为单质气体,D为白色沉淀,B可能是共价化合物,也可能是离子化合物 |
| D、若B为单质气体,X可能为C、Na、N2+等 |
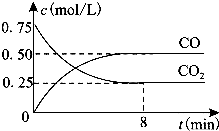 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.