题目内容
某研究性学习小组为测定某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用如图所示的仪器装置进行实验(②装置未画全).试回答有关问题:
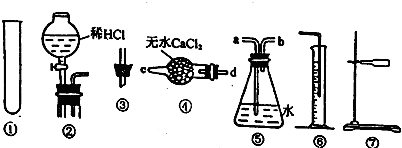
实验一:测定Na2CO3样品中NaHCO3分解放出CO2体积.
连接装置的正确顺序是:⑦①③④⑤⑥
(1)写出加热时发生反应的化学方程式 .
(2)完成该实验尚缺的仪器是 (填名称);产生气体从装置④的 进入,从装置⑤的 进入(填接口序号).
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积.
(3)应将实验一连接装置的顺序作哪些调整? .
(4)当实验一加热至样品不再产生气体时,产生CO2体积为a L(已换算成标况下的体积,下同),则样品中NaHCO3的质量为 ;实验二在加入盐酸至无气体产生时,生成CO2体积为bL,则Na2CO3样品的纯度为 (用含a、b的式子表示).
误差分析:
(5)为什么不能将⑤中的水改用Na2CO3饱和溶液?请用离子方程式说明原因 .
(6)有同学发现在实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值 (填“偏大”、“偏小”或“无影响”).

实验一:测定Na2CO3样品中NaHCO3分解放出CO2体积.
连接装置的正确顺序是:⑦①③④⑤⑥
(1)写出加热时发生反应的化学方程式
(2)完成该实验尚缺的仪器是
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积.
(3)应将实验一连接装置的顺序作哪些调整?
(4)当实验一加热至样品不再产生气体时,产生CO2体积为a L(已换算成标况下的体积,下同),则样品中NaHCO3的质量为
误差分析:
(5)为什么不能将⑤中的水改用Na2CO3饱和溶液?请用离子方程式说明原因
(6)有同学发现在实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题
分析:测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积;
(1)某Na2CO3样品的纯度(其中只含NaHCO3杂质),加热碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(2)实验装置中需要酒精灯加热,气体流向在装置④中应从d进c出,装置⑤是排水量气需要短进长出,b进a出;
(3)测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积;测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积;
(4)当实验一测得产生的二氧化碳为a L,当实验二测得产生的二氧化碳为bL,反应的相关方程式为,2NaHCO3
Na2CO3+CO2↑+H2O,Na2CO3+2HCl═2NaCl+CO2↑+H2O,结合反应的方程式计算;
(5)二氧化碳和碳酸钠溶液反应生成碳酸氢钠;
(6)⑥中液体的液面低于⑤中液体的液面,压强不平衡,待液面平衡后读取;
(1)某Na2CO3样品的纯度(其中只含NaHCO3杂质),加热碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(2)实验装置中需要酒精灯加热,气体流向在装置④中应从d进c出,装置⑤是排水量气需要短进长出,b进a出;
(3)测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积,可将固体混合物放入试管中加热,生成的二氧化碳气体用排水法测量体积;测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积;
(4)当实验一测得产生的二氧化碳为a L,当实验二测得产生的二氧化碳为bL,反应的相关方程式为,2NaHCO3
| ||
(5)二氧化碳和碳酸钠溶液反应生成碳酸氢钠;
(6)⑥中液体的液面低于⑤中液体的液面,压强不平衡,待液面平衡后读取;
解答:
解:(1)某Na2CO3样品的纯度(其中只含NaHCO3杂质),加热碳酸氢钠分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3
Na2CO3+CO2↑+H2O;
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(2)反应应在加热条件下进行,实验中缺少酒精灯,实验装置中需要酒精灯加热,气体流向在装置④中应从d进c出,装置⑤是用排水法测量气体的体积时需要短进长出,b进a出;
故答案为:酒精灯,d,b;
(3)测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积,应将实验一连接装置的顺序调整为将①装置换成②装置;
故答案为;将①装置换成②装置;
(4)当实验一测得产生的二氧化碳为a L,反应的相关方程式为,
2NaHCO3
Na2CO3+CO2↑+H2O,
2 1 1
n
mol
mol
n=
mol
则样品中NaHCO3的质量为
mol×84g/mol=7.5ag;
当实验二测得产生的二氧化碳为b L,
Na2CO3+2HCl═2NaCl+CO2↑+H2O,
设混合物中含有xmolNaHCO3,ymolNa2CO3,x=
mol
+y=
y=
-
则样品中碳酸钠的质量为106(
-
)g,NaHCO3的质量为84×
=7.5ag,
则样品中碳酸钠纯度的实验值为=
×100%=
×100%,
故答案为:7.5ag;
×100%;
(5)不能将⑤中的水改用Na2CO3饱和溶液是因为二氧化碳和碳酸钠溶液反应生成碳酸氢钠,费用的 离子方程式为:CO32-+CO2+H2O═2HCO3-;
故答案为:CO32-+CO2+H2O═2HCO3-;
(6)实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,压强不平衡,待液面平衡后读取,此时读取a值偏小;
故答案为:偏小;
| ||
故答案为:2NaHCO3
| ||
(2)反应应在加热条件下进行,实验中缺少酒精灯,实验装置中需要酒精灯加热,气体流向在装置④中应从d进c出,装置⑤是用排水法测量气体的体积时需要短进长出,b进a出;
故答案为:酒精灯,d,b;
(3)测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积,应将固体放入试管中,将盐酸放入分液漏斗中,然后用排水法测量气体的体积,应将实验一连接装置的顺序调整为将①装置换成②装置;
故答案为;将①装置换成②装置;
(4)当实验一测得产生的二氧化碳为a L,反应的相关方程式为,
2NaHCO3
| ||
2 1 1
n
| a |
| 22.4 |
| a |
| 22.4 |
n=
| a |
| 11.2 |
则样品中NaHCO3的质量为
| a |
| 11.2 |
当实验二测得产生的二氧化碳为b L,
Na2CO3+2HCl═2NaCl+CO2↑+H2O,
设混合物中含有xmolNaHCO3,ymolNa2CO3,x=
| a |
| 11.2 |
| a |
| 22.4 |
| b |
| 22.4 |
y=
| b |
| 22.4 |
| a |
| 22.4 |
则样品中碳酸钠的质量为106(
| b |
| 22.4 |
| a |
| 22.4 |
| a |
| 11.2 |
则样品中碳酸钠纯度的实验值为=
(
| ||||
106×(
|
| 106(b-a) |
| 106b+62a |
故答案为:7.5ag;
| 106(b-a) |
| 106b+62a |
(5)不能将⑤中的水改用Na2CO3饱和溶液是因为二氧化碳和碳酸钠溶液反应生成碳酸氢钠,费用的 离子方程式为:CO32-+CO2+H2O═2HCO3-;
故答案为:CO32-+CO2+H2O═2HCO3-;
(6)实验一读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,压强不平衡,待液面平衡后读取,此时读取a值偏小;
故答案为:偏小;
点评:本题考查物质的含量测定,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,难度中等,注意把握实验的原理和实验装置的连接顺序.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
人的胃液正常pH在1.2~0.3之间,酸度再高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药剂成分的是( )
| A、氧化镁粉 | B、氢氧化镁 |
| C、氧化钙 | D、纯碳酸钙粉 |
